Что такое макрофаги? GcMAF уникальный препарат для активации деятельности макрофагов. Ученые нашли способ регулировать активность макрофагов Основные функции макрофагов включают
Что такое макрофаги? GcMAF уникальный препарат для активации деятельности макрофагов. Ученые нашли способ регулировать активность макрофагов Основные функции макрофагов включают
Активация — самый важный этап функционального созревания макрофагов. Активирующим действием обладают определенные цитокины — белковые соединения, которые осуществляют передачу сигнала между клетками и тем самым влияют на процесс воспаления или иммунный ответ. К этим цитокинам относятся интерфероны, интерлейкины, ростовые факторы, хемокины и ФНО. Те из них, которые активируют макрофаги, включают ИФН-у, ГМ-КСФ, М-КСФ и ФНО-а.
Активируют макрофаги также гормон роста и бактериальный эндотоксин или белки клеточной стенки. Термин «активированный макрофаг» в самом широком смысле означает, что он обладает повышенной способностью убивать микроорганизмы или опухолевые клетки. После активации макрофаги становятся крупнее, у них увеличивается число псевдоподий, а плазматическая мембрана приобретает бо, льшую складчатость.
Интенсивные функции активированных макрофагов:
• Бактерицидная активность.
• Противоопухолевая активность.
• Хемотаксис.
• Фагоцитоз (большинства частиц).
• Пиноцитоз.
• Транспорт и метаболизм глюкозы.
• Сопровождающая фагоцитоз продукция свободных радикалов (О2, Н2О2).
• Образование оксида азота.
• Представление антигенов.
• Секреция:
– компонентов комплемента;
– лизоцима;
– кислых гидролаз;
– коллагеназы;
– активатора плазминогена;
– цитолитической протеазы;
– аргиназы;
– фибронектина;
– интерлейкинов (ИЛ-1, ИЛ-10, ИЛ-12, ИЛ-15);
– ФНО-а;
– ИФН-а и -b.
• Факторы ангиогенеза.
Активация макрофагов при инфекции происходит путем взаимодействия их поверхностной молекулы CD40 с лигандом CD40 на сенсибилизированных антигеном Th-клетках, а также вследствие действия цитокинов, продуцируемых этими лимфоцитами. Активированные макрофаги выделяют ИЛ-12, который, в свою очередь, активирует Т-лимфоциты. Эти взаимодействия составляют основу клеточного иммунитета.
Особенно важный активирующий макрофаги цитокин, ИФН-у, используют в настоящее время для профилактики инфекций у больных с хронической гранулематозной болезнью и для лечения врожденного остеопетроза (замедления резорбции костей), связанного со снижением функции остеокластов.
При воздействии эндотоксина или других медиаторов воспаления макрофаги выделяют ФНО-а, который активирует другие макрофаги. Активированные макрофаги экспрессируют большее число рецепторов ФНО-а. Таким образом, макрофаги в очагах воспаления приобретают способность активировать друг друга и тем самым осуществлять свои функции быстрее, чем при классическом клеточном иммунном ответе, который требует накопления сенсибилизированных Т-лимфоцитов.
С другой стороны, макрофаги, как и Th-клетки, секретируют ИЛ-10, ингибирующий продукцию ИФН-у и тормозящий потенциально опасные последствия неконтролируемой активации макрофагов.
Макрофаги: что это такое, и какова их роль в иммунной защите организма
Иммунитетом называется совокупность клеточных и гуморальных средств защиты организма от инфекционных и опухолевых заболеваний. Реализуется благодаря существованию таких клеток, как лимфоциты, плазмоциты и макрофаги. Что это такое, следует разобраться детальнее. Значение этих клеток действительно велико для организма и обеспечения его жизнедеятельности в агрессивной окружающей среде.

Происхождение макрофагов
Макрофагом называется клетка костномозгового происхождения, которая после миграции из сосудистого русла под действием цитокинов дифференцировалась в фагоцит. Строго говоря, макрофаги — это фагоциты, то есть клетки активного иммунитета, способные захватывать антигены и презентовать их на своих мембранах для плазмоцитов. Также они способны фагоцитировать антигены, устраняя их из организма. В качестве предшественника данного фагоцита выступает моноцит – клетка костномозгового происхождения, циркулирующая в крови. В макрофаг она превращается после того, как попадает в межклеточное пространство из сосудистого русла. Здесь под действием цитокинов происходит его типизация.
Разновидности макрофагов
Макрофаги – тип белых кровяных клеток, которые невозможно найти в кровеносных сосудах. Они локализованы в межальвеолярных промежутках, в селезенке, среди нервных волокон, в лимфоузлах и в серозных оболочках. Также они в большом количестве представлены в межклеточном пространстве других тканей, где защищают их от антигенов. В зависимости от локализации выделяют некоторые виды макрофагов. Разновидности этих клеток позволяют отследить, какие антигены им предстоит фагоцитировать.

Первый тип макрофагов — это гистиоцит. Это самый частый вид фагоцита, который содержится во многих тканях. Это большая клетка размером до 80 мкм, которая захватывает бактерии, вирусы или инородные тела и переваривает их.
Второй тип — макрофаги лимфоузлов. По строению они мало отличаются от гистиоцитов и выполняют аналогичные функции.
Резидентные макрофаги
Третий тип — резидентные макрофаги. Особый вид фагоцитов, которые приобретают специфические черты в зависимости от места нахождения. Среди резидентных выделяют альвеолярные, купферовские клетки, макрофаги селезенки, дендритные клетки. Альвеолярные макрофаги находятся в межальвеолярных промежутках, где захватывают бактерии и вирусы, устраняя их из внутренней среды организма на ее границе с воздушной средой.

В случае захвата твердой частицы, которую ферментные системы не могут расщепить, макрофаг постепенно погибает. После этого инородное тело вновь контактирует с внешней средой. Новые макрофаги, как клетки иммунитета, также пытаются фагоцитировать его либо сформировать вокруг него очаги фиброза. Это приводит к хроническим легочным заболеваниям, особенно у курильщиков и работников в горнодобывающих отраслей.
Купферовские и селезеночные макрофаги
Купферовские клетки — специфический тип резидентных макрофагов, расположенных в печени. Их задачей является уничтожение клеток крови, которые достаточно долго присутствуют в кровотоке и потеряли свое значение. Макрофаг определяет их по отсутствию некоторых мембранных антигенов, которые теряются в процессе жизни клетки. Чаще всего купферовским типом уничтожаются многие лейкоциты, опухолевые клетки крови, эритроциты.
Селезеночные макрофаги, как и купферовские, также устраняют эритроциты и лейкоциты из кровотока. Однако расположены в селезенке. Макрофаги этого органа также захватывают железо и, накопив достаточное его количество, мигрируют в костный мозг, становясь клеткой-кормушкой для растущих новых эритроцитов. Этим демонстрируется пример транспортной функции, которую осуществляют макрофаги. Что это такое с точки зрения гистологии? Не что иное, как особенность тканевой дифференцировки под действием цитокинов.
Дендритные резидентные макрофаги
Макрофагальные клетки, расположенные на границе эпителия, называются дендритными. Их название происходит от наличия множества отростков, при помощи которых клетка захватывает инородное тело и крепится между цитолеммами других клеток эпителия. Дендритные макрофаги находятся на границе между сосудами и внешней средой. В коже они располагаются проксимально относительно дермы, а в кишечном и бронхиальном эпителии эксцентрично от базальной мембраны.
Особенности строения макрофагов
Рассматривая макрофаги (что это такое, описано выше), следует выделить ключевые особенности их строения. Во-первых, они сильно зависят от нахождения. Во-вторых, они имеют крупные размеры. В-третьих, они обладают подвижностью и способны мигрировать к участкам воспаления, где отмечается повышенная концентрация цитокинов. Указанные особенности строения следует рассмотреть подробнее.
Итак, макрофаги дифференцируются на месте в зависимости от наличия особых цитокинов, а потому уже после своего превращения получают новые рецепторы и функции. То есть их структура меняется в зависимости от локализации. Также они происходят от моноцитов, самых крупных из клеток крови. Потому их размеры от 15 до 80 мкм заложены в них еще до дифференцировки в резидентные макрофаги (что это такое, описано выше). После этого новые макрофагальные клетки из числа резидентных могут самостоятельно делиться на месте, уже имея свой набор афинных молекул для активации фагоцитоза без участия клеточного иммунитета.
Третья особенность структуры — возможность самостоятельно передвигаться по направлению к цитокинам. Для передвижения они имеют лженожки, также необходимые для упрощения образования полости при фагоцитировании инородного тела. Также они способны менять свою форму, проталкиваясь в капиллярные фенестры. Все это делает макрофаг универсальным фагоцитом, отвечающим за непосредственное устранение инородных тел внутренней среды организма.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
- 9216
- 7,9
- 5
- 4
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.

Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».

Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
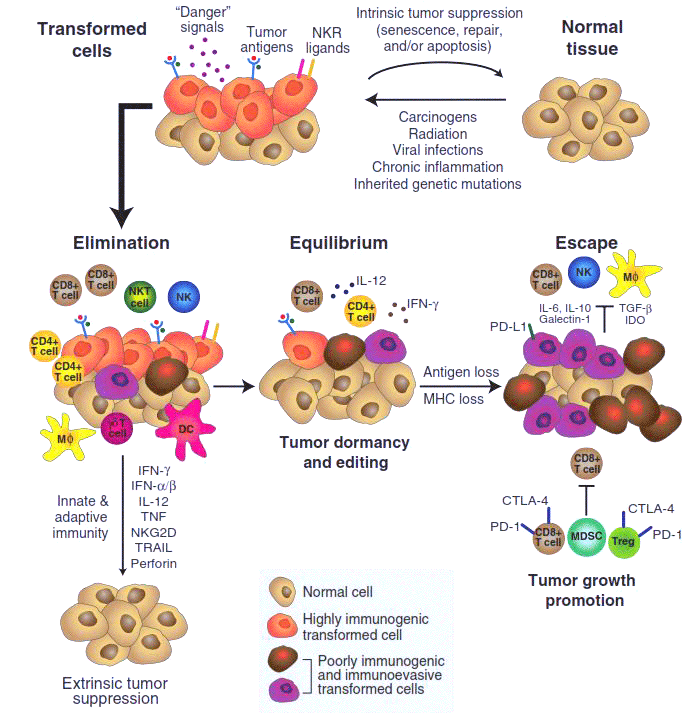
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
Макрофаги, пожалуй, самые знаменитые клетки врожденного иммунитета — именно с изучения их способностей к фагоцитозу Мечниковым и началась классическая клеточная иммунология. В организме млекопитающих макрофаги — боевой авангард: первыми обнаруживая врага, они не только пытаются уничтожить его собственными силами, но также привлекают к месту сражения другие клетки иммунной системы, активируя их. А после уничтожения чужеродных агентов принимаются активно участвовать в ликвидации причиненных повреждений, вырабатывая факторы, способствующие заживлению ран. Эту двойственную природу макрофагов опухоли используют себе на пользу.
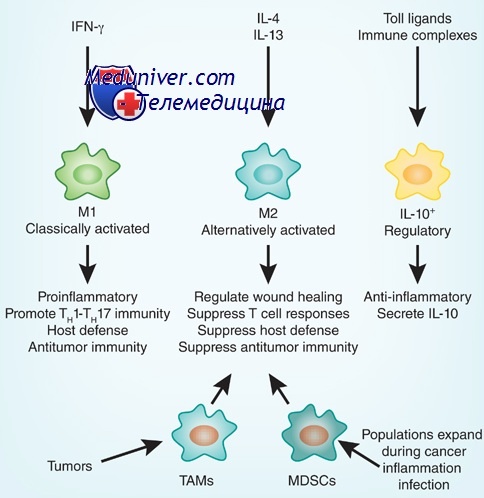
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
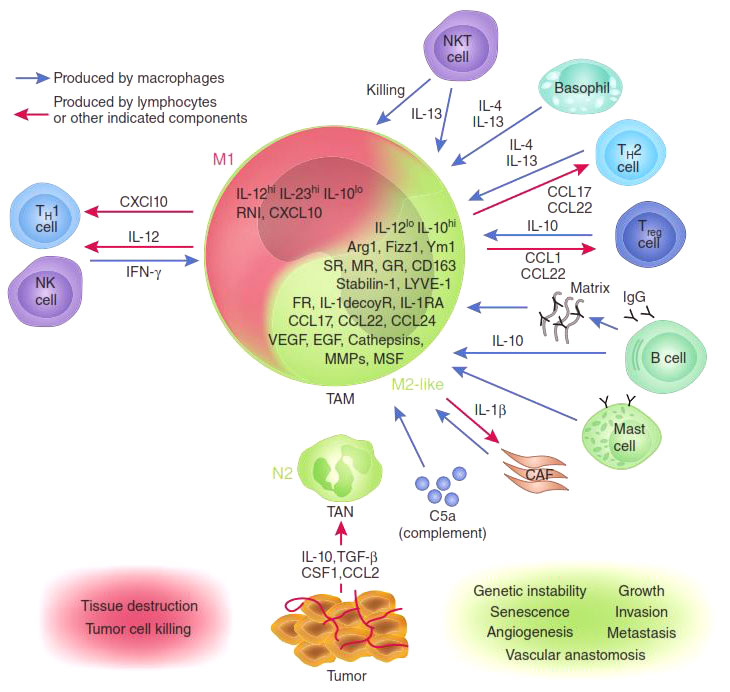
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Развитие методов антираковой терапии в настоящее время идет по нескольким направлениям сразу , и все они важны. Ведь научившись управлять иммунным ответом так же эффективно, как это делают злокачественные опухоли, мы сумеем окончательно «переиграть» эту болезнь, которая остается одной из главных причин смертности в России и в мире.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Что такое макрофаги? GcMAF уникальный препарат для активации деятельности макрофагов.
МАКРОФАГИ. Макрофаг (с др. греческого большой пожиратель») представляют собой особый вид крупных белых клеток крови, которые одновременно с теми клетками, которые, по сути, являются их предшественниками создают симбиоз, именуемый системой монуклеарных фагоцитов (с др. греческого «поглощать (есть) клетку»). В качестве клеток-предшественников в данном случае выступают монобласты промоциты и моноциты.
Происхождение и назначение макрофагов
Макрофаги называют клетками-«мусорщиками» неспроста, так как все, с чем они соприкасаются, поглощается и уничтожается посредством переваривания. Определенная доля макрофагов постоянно располагается в определенных местах: в капиллярах и лимфатических узлах, в печени, в легких, в соединительной и нервной тканях, в костях, включая костный мозг. Другие блуждают между клетками, постепенно скапливаясь в тех местах, где наиболее вероятно проникновение в организм того или иного возбудителя инфекции.
Все типы макрофагов происходят из моноцитов крови, а моноциты, в свою очередь, появляются из промоноцитов костного мозга, постепенносозревающих из более ранних клеток-предшественников до достижения определенной стадии. Примечательно, что у макрофагов существует обратная связь с этими клетками-предшественниками; обеспечиваемая благодаря их способности продуцировать в кровь цитокины (ростовые факторы), которые поступают с кровью в костный мозг, тем самым усиливая естественные процессы деления клеток, образованных ранее. Данный процесс активизируется, например, при наличии тех или иных инфекций, когда многие макрофаги погибают в борьбе с «врагами», им на сменупоставляются новые макрофаги, в ускоренном темпе созревающие в костном мозге.
Как «работают» макрофаги при наличии инфекций в организме?

Первыми из иммунных клеток с микробом встречаются макрофаги, являясь своего рода «разведчиком», цель которого тщательно изучить враждебную ему клетку при помощи своих рецепторов, в качестве которых выступают разные молекулы, расположенные на их поверхности.После проникновения в организм вирусы, бактерии, паразиты (микробы) выделяют свои молекулы-токсины; макрофаги распознают их своими соответствующими рецепторами и концентрируются в месте максимального скопления «врагов» в очаге. Там начинается основная работа макрофагов захватить «врагов» (фаготицоз), попытаться убить их во внутриклеточных вакуолях и переварить, то есть очистить организм от «врагов».
Воздействие микробных токсинов на конкретные рецепторы является сигналом для активации генов в геноме макрофагов. Макрофаг выделяет в кровь молекулы-цитокины, выступающие в качестве связующего звена между макрофагами и клетками всего организма. Функционируя непосредственно в очаге инфекции, макрофаги нарабатывают и выделяют молекулы интерлейкина-1, которые посредством кровотока направляются в мозг и уже там оказывают нужное воздействие на центр терморегуляции, в результате чего у пациента повышается температура,включая таким образом один из самых древних основных защитных механизмов организма. В результате размножение большинства паразитирующих микробов при повышенной температуре резко замедляется; защитные же клетки наоборот становятся гораздо болееактивными, что делает борьбу с заболеванием гораздо эффективней. Молекулы интерлейкина-1 действуют через свои рецепторы на лимфоциты, передавая им сигнал активации. Продукт макрофагов интерлейкин-1 способен запустить серию других цитокинов интерлейкины-2,3,4,5,6,7,8,9 итд, которые находят соответствующие рецепторы на Т- лимфоцитах, В-лимфоцитах и других клетках, передавая им сигналы, способствующие активации отдельных функций. Это исключительно важно в тех случаях, когда одни макрофаги, без подключения дополнительных «сил», не в состоянии побороть инфекцию, вследствие чего возникает необходимость включения иммунного ответа одновременно всех звеньев иммунитета.
Непосредственно в очаге инфекции макрофаги постоянно нарабатывают определенные продукты, среди которых особое место уделяетсяотдельным молекулам, именуемым фактор некроза опухолей (ФНО). Такое название связано с их способностью к поражению клеток- мишеней, к числу которых относятся и опухолевые клетки. Ранее их гибель расценивалась не иначе как некроз. Рецепторы, предназначенные для данного фактора, обнаружены на поверхности всех ядерных клеток, что обеспечивает возможность ФНО вмешиваться в разные процессы. Фактор некроза опухолей имеет непосредственное отношение к направлению молекул в очаг инфекции, откуда они начинают активное рецепторное воздействие на эндотелиальные клетки внутренней оболочки сосудов. В эндотелиальных клетках активации подвергаются гены, ответственные за синтез особых молекул, которые обеспечивают прилипание к сосудистой стенке циркулирующих в крови гранулоцитов, моноцитов, лимфоцитов.
Прилипание к эндотелию для клетки шаг к выходу из сосуда и мобилизации в очаге инфекции. ФНО помогает макрофагам, способствуетувеличению количества макрофагов в очаге инфекции. У самих макрофагов есть рецепторы для ФНО, через которые он может активировать макрофаги, посылая с поверхности этих клеток сигналы к ядру, после чего включаются разные гены для организации ответа на «вторжение».
GcMAF уникальный препарат для активации деятельности макрофагов
К сожалению для нас, несмотря на свои колоссальные возможности, макрофаги могут быть неактивны. Например, все клетки злокачественных опухолей, а также вирусные и инфекционные клетки продуцируют белок альфа-N- ацетилгалактозаминидаза (нагалаза), который блокирует продукцию GcMAF-гликопротеина, стимулирующего активацию макрофагов, препятствуя таким образом нормальной деятельности иммунной системы. А в отсутствии активности иммунной системы неконтролируемо развиваются злокачественные опухоли и возрастает уровень вирусных инфекций. На этот случай существует препарат GcMAF, который активирует макрофаги и усиливает активность иммунного ответа. Приобрести подлинный GcMAF можно в клинике доктора Ведова.