Процесс дифференцировки клеток и тканей. Дифференцировка клеток. Цитокины и мессенджеры
Цитокины и их рецепторы. Функции цитокинов как сигнальных молекул
Регуляция процессов пролиферации и апоптоза клеток ткани.
См. Шмидт, Тевс Физиология человека, т.2. гл. 17.1.
Эндокринный, паракринный и нейрокринный механизмы передачи сигнала тканям и органам.
· Самуилов В.Д. Программируемая клеточная смерть у растений // СОЖ.- 2001. – т.7. – №10. – с.12 – 17.
· Самуилов В.Д. Программируемая клеточная смерть у растений // СОЖ.- 2001. – т.7. – №10. – с.18 – 25.
· Васильев Ю.М. Социальное поведение нормальных клеток и антисоциальное поведение опухолевых клеток: ч.1, 2 // СОЖ. – 1997. – №4, с. 17-22; №5, с. 20-25
См. Цитокины и их клеточные рецепторы.
Цитокины – небольшие пептидные информационные молекулы. Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Термин предложен англ. S. Cohen в 1974 г.
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. По механизму действия можно разделить цитокины на следующие группы:
- провоспалительные, обеспечивающие мобилизацию воспалительного ответа (интерлейкины 1,2,6,8, ФНОα, интерферон γ);
- противовоспалительные, ограничивающие развитие воспаления (интерлейкины 4,10, TGFβ);
- регуляторы клеточного и гуморального иммунитета (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины – антигеннеспецифические факторы. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники: например, интерлейкин-1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
Цитокины – регуляторы иммунных реакций, специфические белки, с помощью которых разнообразные клетки иммунной системы могут обмениваться друг с другом информацией и осуществлять координацию действий. Набор и количества цитокинов, действующих на рецепторы клеточной поверхности, – “цитокиновая среда” – представляют собой матрицу взаимодействующих и часто меняющихся сигналов. Эти сигналы носят сложный характер из-за большого разнообразия цитокиновых рецепторов и из-за того, что каждый из цитокинов может активировать или подавлять несколько процессов, включая свой собственный синтез и синтез других цитокинов, а также образование и появление на поверхности клеток цитокиновых рецепторов. Для различных тканей характерна своя здоровая “цитокиновая среда”. Обнаружено более сотни разнообразных цитокинов (см. таблицу).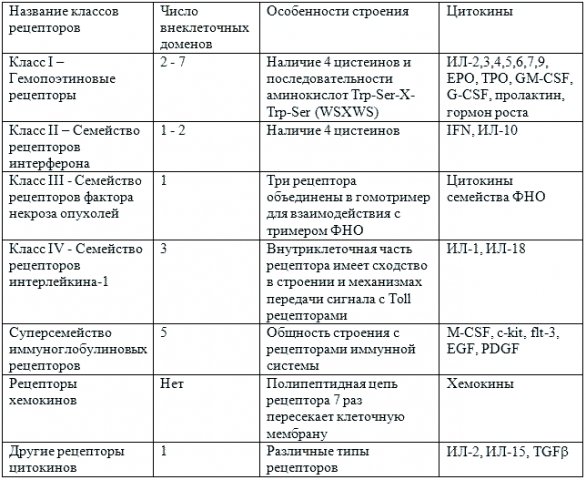
Цитокины являются важным элементом при взаимодействии разных лимфоцитов между собой и с фагоцитами. Именно посредством цитокинов Т-хелперы помогают координировать работу разнообразных клеток, задействованных в иммунной реакции.
С момента открытия в 1970-х годах интерлейкинов до настоящего времени обнаружено более 20 биологически активных веществ. Различные цитокины регулируют пролиферацию и дифференцировку иммунокомпетентных клеток. Но если влияние цитокинов на указанные процессы изучено довольно хорошо, то данные по действию цитокинов на апоптоз появились сравнительно недавно. Их следует учитывать и при клиническом использовании цитокинов.
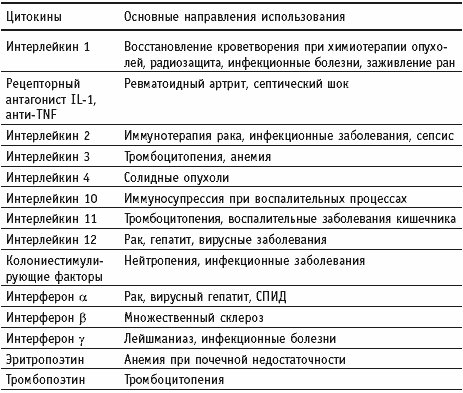
Параллельно с открытием факторов роста было идентифицировано несколько экстраклеточных сигнальных белков, взаимодействующих с клетками иммунной системы . Это локальные пептидные гормоны, регулирующие парокринную и аутокринную функции ( Интерлейкины , интерфероны, фактор некроза опухоли (TNF)). В связи с тем, что они активировали или модулировали пролиферативные свойства клеток этого класса, они были названы иммуноцитокинами. После того, как стало известно, что эти соединения взаимодействуют не только с клетками иммунной системы, их название сократилось до цитокинов. Цитокины включают в себя некоторые факторы роста, такие как интерфероны, фактор некроза опухоли (TNF), ряд интерлейкинов , колонии стимулирующий фактор (CSF) и многие другие.
Межклеточная сигнализация в иммунной системе осуществляется путем непосредственного контактного взаимодействия клеток или с помощью медиаторов межклеточных взаимодействий. При изучении дифференцировки иммунокомпетентных и гемопоэтических клеток, а также механизмов межклеточного взаимодействия, формирующих иммунный ответ, была открыта большая и разнообразная группа растворимых медиаторов белковой природы – молекул-посредников (“белков связи”), участвующих в межклеточной передаче сигналов и названных в последующем цитокинами . Гормоны обычно исключают из этой категории на основании эндокринного (а не паракринного или аутокринного) характера их действия.
Вместе с гормонами и нейромедиаторами они составляют основу языка химической сигнализации, путем которой в многоклеточном организме регулируется морфогенез и регенерация тканей. В положительной и отрицательной регуляции иммунного ответа им принадлежит центральная роль. К настоящему времени у человека обнаружено и изучено в той или иной степени уже более ста цитокинов, и постоянно появляются сообщения об открытии новых. Для некоторых получены генно-инженерные аналоги. Цитокины действуют через активацию рецепторов цитокинов. Достаточно часто подразделение цитокинов на ряд семейств проводят не по их функциям, а по характеру трехмерной структуры, что отражает внутригрупповое сходство по конформации и аминокислотной последовательности специфических клеточных цитокиновых рецепторов. Основная биологическая активность цитокинов – регуляция иммунного ответа на всех этапах его развития, в которой они играют центральную роль. В целом вся эта большая группа эндогенных регуляторов обеспечивает самые разнообразные процессы, такие как:
– пролиферация и дифференцировка предшественников функционально активных иммунокомпетентных клеток,
– хемотаксис,
– изменение экспрессии антигенов и различных маркеров,
– переключение синтеза иммуноглобулинов,
– индукция цитотоксичности у макрофагов,
– формирование очага воспаления .
Цитокины – это небольшие белки (мол. масса от 8 до 80 КДа), действующие, как уже говорилось выше, аутокринно (т.е. на клетку, которая их продуцирует) или паракринно (на клетки, расположенные вблизи). Образование и высвобождение этих высокоактивных молекул происходит кратковременно и жестко регулируется.
Цитокины, которые синтезируются лимфоцитами и являются регуляторами пролиферации и дифференцировки, в частности, гематопоэтических клеток и клеток иммунной системы называют также лимфокинами . Они включают в себя интерлейкины (IL) – (от inter -между, leukins белые клетки крови), интерфероны и колоний стимулирующие факторы . IL продуцируются и действуют на белые клетки крови. Колониестимулирующие факторы – (гранулоцит макрофаг колоний стимулирующий фактор, например) стимулируют гемопоэз, процесс превращения предшественников в белые и красные клетки крови. Некоторые цитокины регулируют пролиферацию нервных клеток и экспрессию в них генов. Цитокины могут быть разделены на несколько групп: гемопоэтины, интерфероны, TNF-родственные молекулы, члены суперсемейства иммуноглобулинов и хемокины.
 Многие тяжелые заболевания приводят к значительному повышению уровня IL-1 и TNF альфа. Эти цитокины способствуют активации фагоцитов, их миграции в место воспаления, а также высвобождению медиаторов воспаления-производных липидов, то есть простагландина Е2, тромбоксанов и фактора активации тромбоцитов. Кроме того, они прямо или опосредованно вызывают расширение артериол, синтез адгезивных гликопротеидов, активируют Т- и В-лимфоциты. ИЛ-1 запускает синтез IL-8, способствующего хемотаксису моноцитов и нейтрофилов и выходу ферментов из нейтрофилов. В печени снижается синтез альбумина и усиливается синтез белков острой фазы воспаления, включая ингибиторы протеаз, компоненты комплемента, фибриноген, церулоплазмин, ферритин и гаптоглобин. Уровень С-реактивного белка , который связывается с поврежденными и погибшими клетками, а также некоторыми микроорганизмами, может повышаться в 1000 раз. Возможно также значительное повышение концентрации амилоида A в сыворотке и его отложение в различных органах, приводящее к вторичному амилоидозу. Важнейшим медиатором острой фазы воспаления является IL-6, хотя IL-1 и TNF альфа тоже могут вызывать описанные изменения функции печени. IL-1 и TNF альфа усиливают влияние друг друга на местные и общие проявления воспаления, поэтому сочетание этих двух цитокинов даже в небольших дозах способно вызвать полиорганную недостаточность и стойкую артериальную гипотонию. Подавление активности любого из них устраняет это взаимодействие и заметно улучшает состояние больного. IL-1 сильнее активирует Т- и В-лимфоциты при 39*С, чем при 37*С. IL-1 и TNF альфа вызывают снижение безжировой массы тела и потерю аппетита , приводящие к кахексии (истощению) при длительной лихорадке. Эти цитокины попадают в кровоток лишь на короткое время, но его оказывается достаточно, чтобы запустить продукцию IL-6 . IL-6 постоянно присутствует в крови, поэтому его концентрация в большей степени соответствует выраженности лихорадки и других проявлений инфекции. Тем не менее IL-6 в отличие от IL-1 и TNF альфа не считают летальным цитокином.
Многие тяжелые заболевания приводят к значительному повышению уровня IL-1 и TNF альфа. Эти цитокины способствуют активации фагоцитов, их миграции в место воспаления, а также высвобождению медиаторов воспаления-производных липидов, то есть простагландина Е2, тромбоксанов и фактора активации тромбоцитов. Кроме того, они прямо или опосредованно вызывают расширение артериол, синтез адгезивных гликопротеидов, активируют Т- и В-лимфоциты. ИЛ-1 запускает синтез IL-8, способствующего хемотаксису моноцитов и нейтрофилов и выходу ферментов из нейтрофилов. В печени снижается синтез альбумина и усиливается синтез белков острой фазы воспаления, включая ингибиторы протеаз, компоненты комплемента, фибриноген, церулоплазмин, ферритин и гаптоглобин. Уровень С-реактивного белка , который связывается с поврежденными и погибшими клетками, а также некоторыми микроорганизмами, может повышаться в 1000 раз. Возможно также значительное повышение концентрации амилоида A в сыворотке и его отложение в различных органах, приводящее к вторичному амилоидозу. Важнейшим медиатором острой фазы воспаления является IL-6, хотя IL-1 и TNF альфа тоже могут вызывать описанные изменения функции печени. IL-1 и TNF альфа усиливают влияние друг друга на местные и общие проявления воспаления, поэтому сочетание этих двух цитокинов даже в небольших дозах способно вызвать полиорганную недостаточность и стойкую артериальную гипотонию. Подавление активности любого из них устраняет это взаимодействие и заметно улучшает состояние больного. IL-1 сильнее активирует Т- и В-лимфоциты при 39*С, чем при 37*С. IL-1 и TNF альфа вызывают снижение безжировой массы тела и потерю аппетита , приводящие к кахексии (истощению) при длительной лихорадке. Эти цитокины попадают в кровоток лишь на короткое время, но его оказывается достаточно, чтобы запустить продукцию IL-6 . IL-6 постоянно присутствует в крови, поэтому его концентрация в большей степени соответствует выраженности лихорадки и других проявлений инфекции. Тем не менее IL-6 в отличие от IL-1 и TNF альфа не считают летальным цитокином.
Таким образом, цитокины выполняют огромное количество функций, направленных на защиту организма от повреждающих агентов (в основном инфекционной и опухолевой природы), на поддержание гомеостаза организма.
Информация предоставлена сайтом https://humbio.ru
Классификация цитокинов
Дифференцировка клеток. Факторы и регуляция дифференцировки. Стволовая клетка и дифферон
ДИФФЕРЕНЦИРОВКА И ПАТОЛОГИЯ КЛЕТОК
Дифференцировка клеток. Факторы и регуляция дифференцировки. Стволовая клетка и дифферон
Апоптоз и некроз
Опухолевая трансформация клеток
Дифференцировка клеток. Факторы и регуляция дифференцировки. Стволовая клетка и дифферон
Этот вопрос относится к числу наиболее сложных и в тоже время интересных как для цитологии, так и для биологии. Дифференцировка-это процесс возникновения и развития структурных и функциональных различий между первоначально однородными эмбриональными клетками, в результате которого образуются специализированные клетки, ткани и органы многоклеточного организма. Дифференцировка клеток является важнейшей составной частью процесса формирования многоклеточного организма. В общем случае дифференцировка необратима, т.е. высокодифференцированные клетки не могут превращаться в клетки другого типа. Это явление называется терминальной дифференцировкойи присуще преимущественно клеткам животных. В отличие от клеток животных, большинство клеток растений даже после дифференцировки способны переходить к делению и даже вступать на новый путь развития. Такой процесс называется дедифференцировкой. Например, при надрезе стебля некоторые клетки в зоне разреза начинают делиться и закрывают рану, другие вообще могут подвергаться дедифференцировке. Так клетки коры могут превратиться в клетки ксилемы и восстановить непрерывность сосудов в области повреждения. В экспериментальных условиях при культивировании растительной ткани в соответствующей питательной среде клетки образуют каллус. Каллус – это масса относительно недифференцированных клеток, полученная из дифференцированных клеток растений. При соответствующих условиях из одиночных клеток каллуса можно вырастить новые растения. При дифференцировки не происходит потерь или перестройки ДНК. Об этом убедительно свидетельствуют результаты экспериментов по пересадке ядер из дифференцированных клеток в недифференцированные. Так ядро из дифференцированной клетки вводили в энуклеированную яйцеклетку лягушки. В результате из такой клетки развивался нормальный головастик. Дифференцировка в основном происходит в эмбриональный период, а также на первых стадиях постэмбрионального развития. Кроме того, дифференцировка имеет место в некоторых органах взрослого организма. Например, в кроветворных органах стволовые клетки дифференцируются в различные клетки крови, а в гонадах – первичные половые клетки – в гаметы.
Факторы и регуляция дифференциации.На первых этапах онтогенеза развитие организма происходит под контролем РНК и других компонентов, находящихся в цитоплазме яйцеклетки. Затем на развитие начинают оказывать влияние факторы дифференцировки.
Выделяют два основных фактора дифференцировки:
1. Различия цитоплазмы ранних эмбриональных клеток, обусловленные неоднородностью цитоплазмы яйца.
2. Специфические влияния соседних клеток (индукция).
Роль факторов дифференцировки заключается в избирательной активации или инактивации тех или иных генов в различных клетках. Активность определенных генов приводит к синтезу соответствующих белков, направляющих дифференциацию. Синтезируемые белки могут блокировать или, напротив, активировать транскрипцию. Первоначально активация или инактивация разных генов зависит от взаимодействия тотипотентных ядер клеток со своей специфической цитоплазмой. Возникновение локальных различий в свойствах цитоплазмы клеток называется ооплазматической сегрегацией. Причина этого явления заключается в том, что в процессе дробления яйцеклетки участки цитоплазмы, различающиеся по своим свойствам, попадают в разные бластомеры. Наряду с внутриклеточной регуляцией дифференцировки с определенного момента включается надклеточный уровень регуляции. К надклеточному уровню регуляции относится эмбриональная индукция.
Эмбриональная индукция – это взаимодействие между частями развивающегося организма, в процессе которого одна часть (индуктор) входит в контакт с другой частью (реагирующей системой) и определяет развитие последней. Причем установлено не только воздействие индуктора на реагирующую систему, но и влияние последней на дальнейшую дифференцировку индуктора.
Под действием какого-либо фактора сначала происходит детерминация.
Детерминацией, или латентной дифференцировкой, называют явление, когда внешние признаки дифференцировки еще не проявились, но дальнейшее развитие ткани уже происходит независимо от фактора, вызвавшего их. Клеточный материал считают детерминированным со стадии, на которой он впервые при пересадке в новое место развивается в орган, который из него образуется в норме.
Стволовая клетка и дифферон.К числу перспективных направлений биологии XXI века относится изучение стволовых клеток. Сегодня исследования стволовых клеток по значимости сопоставимо с исследованиями по клонированию организмов. По мнению ученых применение стволовых клеток в медицине позволит лечить многие “проблемные” заболевания человечества (бесплодие, многие формы рака, диабет, рассеянный склероз, болезнь Паркинсона и др.).
Стволовая клетка – это незрелая клетка, способная к самообновлению и развитию в специализированные клетки организма.
Стволовые клетки подразделяют на эмбриональные стволовые клетки (их выделяют из эмбрионов на стадии бластоцисты) и региональные стволовые клетки (их выделяют из органов взрослых особей или из органов эмбрионов более поздних стадий). Во взрослом организме стволовые клетки находятся, в основном, в костном мозге и, в очень небольших количествах, во всех органах и тканях.
Свойства стволовых клеток. Стволовые клетки самоподдерживаются, т.е. после деления стволовой клетки одна клетка остается в стволовой линии, а вторая дифференцируются в специализированную. Такое деление называется несимметричным.
Функции стволовых клеток. Функция эмбриональных стволовых клеток заключается в передаче наследственной информации и образовании новых клеток. Основная задача региональных стволовых клеток – восстановлениепотерь специализированных клеток после естественной возрастной или физиологической гибели, а также в аварийных ситуациях.
Дифферон – это последовательныйряд клеток, образовавшийся из общего предшественника. Включает стволовые, полустволовые и зрелые клетки.
Например, стволовая клетка, нейробласт, нейрон или стволовая клетка, хондробласт, хондроцит и т. д.
Нейробласт – малодифференцированная клетка нервной трубки, превращающаяся в дальнейшем в зрелый нейрон .
Нейрон – клетка, являющаяся структурной и функциональной единицей нервной системы.
Хондробласт – малодифференцированная клетка хрящевой ткани, превращающаяся в хондроцит (зрелая клетка хрящевой ткани).
Апоптоз и некроз
Апоптоз (с греч. – опадание листьев) – это генетически запрограммированная форма гибели клетки, необходимая в развитии многоклеточного организма и участвующая в поддержании тканевого гомеостаза. Апоптоз проявляется в уменьшении размера клетки, конденсации и фрагментации хроматина, уплотнении плазматической мембраны без выхода содержимого клетки в окружающую среду. Апоптоз обычно противопоставляется другой форме гибели клеток — некрозу, который развивается при воздействии внешних по отношению к клетке повреждающих агентов и неадекватных условий среды (гипоосмия, крайние значения рН, гипертермия, механические воздействия, действие агентов, повреждающих мембрану). Некроз проявляется набуханием клетки и разрывом мембраны вследствие повышения ее проницаемости с выходом содержимого клетки в среду. Первые морфологические признаки апоптоза (конденсация хроматина) регистрируются в ядре. Позже появляются вдавления ядерной мембраны и происходит фрагментация ядра. Отшнуровавшиеся фрагменты ядра, ограниченные мембраной, обнаруживаются вне клетки, их называют апоптотическими тельцами. В цитоплазме происходят расширение эндоплазматической сети, конденсация и сморщивание гранул. Важнейшим признаком апоптоза является снижение трансмембранного потенциала митохондрий. Клеточная мембрана утрачивает ворсинчатость, образует пузыревидные вздутия. Клетки округляются и отделяются от субстрата. Проницаемость мембраны повышается лишь в отношении небольших молекул, причем это происходит позже изменений в ядре. Одной из наиболее характерных особенностей апоптоза является уменьшение объема клетки в противоположность ее набуханию при некрозе. Апоптоз поражает индивидуальные клетки и практически не отражается на их окружении. В результате фагоцитоза, которому клетки подвергаются уже в процессе развития апоптоза, их содержимое не выделяется в межклеточное пространство. Напротив, при некрозе вокруг гибнущих клеток скапливаются их активные внутриклеточные компоненты, закисляется среда. В свою очередь это способствует гибели других клеток и развитию очага воспаления. Сравнительная характеристика апоптоза и некроза клеток приведена в таблице 1.
Таблица 1. Сравнительная характеристика апоптоза и некроза клеток
Процесс дифференцировки клеток и тканей. Дифференцировка клеток. Цитокины и мессенджеры
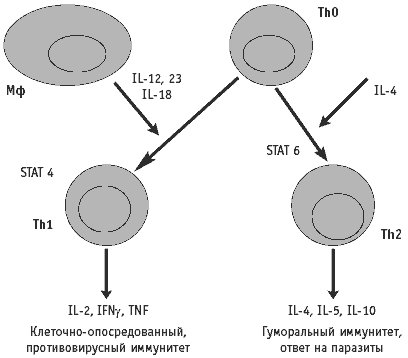
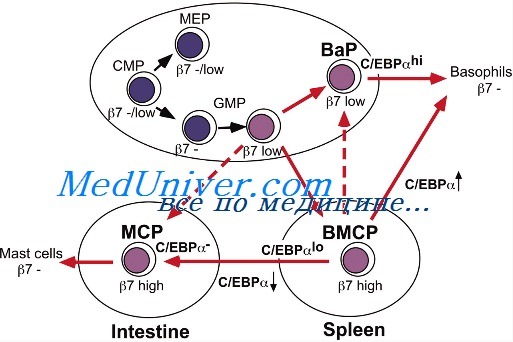
Цитокины регулируют взаимодействия между клетками врожденного и адаптивного иммунного ответа. Функциональная активность цитокинов определяет направление дифференцировки Т-клеток в Th1/ Тс1 или Тh2/Тс2 тип, а также определяет класс иммуноглобулинов, на продукцию которого переключаются В-кпетки.
Тh1-индуцирующие цитокины представлены: IFN-aP, INF-y, IL-18, IL-15, IL-2, IL-12, IL-23, IL-27, IL-6, GM-CSF.
Тип I интерферонов (IFN-а) был идентифицирован одним из первых среди цитокинов, обладающих антивирусной активностью и оказывающих влияние на клетки врожденного иммунитета. Как недавно выявлено, INF играют важную роль в интеграции врожденного и адаптивного иммунитета путем действия на ДК и Т-клетки. Ряд IFN-a/b определяет большую группу скрыто родственных цитокинов, которые активируются при связывании с общим INF-ab рецептором. Эти цитокины включают: IFN-a.
IFN-a образуют моноциты, макрофаги, нейтрофилы, NK и В-лимфоциты, а IFN-b — фибробласты, эпителиальные клетки, макрофаги. Плазмацитоидные предшественники ДК рассматриваются как важнейший тип клеток, продуцирующих тип IIFN (IFN-a/p). Они были названы как натуральные интерферон-продуцирующие клетки — NIPCs. Эти цитокины не только непосредственно ингибируют вирусную репликацию, но также активируют иммунные эффекторы, такие как NK, CTL и макрофаги для элиминации инфицированных клеток.
IFN-a/b способствуют ускорению дифференцировки GM-CSF-обработанных человеческих моноцитов в ДК, стимулирующие активность Т-клеток. Анализ экспрессии маркеров ДК и их миграционного ответа на хемокины показал, что обработка ДК IFN-a/b индуцирует функциональное созревание этих клеток. Противовирусное действие интерферонов связывают с их способностью подавлять процессы транскрипции вирусного генома, а противоопухолевое действие — с подавлением пролиферации клеток вследствие активации аденилатциклазы и повышения уровня цАМФ внутри клетки.
При этом активируется протеинкиназа А, фосфорилирующая белки, подавляется пролиферация и включаются процессы дифференцировки иммунокомпетентных клеток, активируются NK, CTL, макрофаги. IFN-a/B повышают экспрессию молекул МНС на клетках различного типа.
Тип II интерферонов (INF-y), является мощным активатором антимикробных функций фагоцитов и играет ключевую роль в резистентности ко многим патогенным бактериям, грибкам и внутриклеточным паразитам. Он продуцируется в ответ на действие IFN-a/b, вырабатываемых клетками врожденного иммунитета. Источником INF-y являются в основном Th1 клетки и NK, но и другие эффекторы при соответствующей стимуляции также способны секретировать INF-y: Т-клетки (NKT, CD8-T-клетки, и убТ-клетки), макрофаги, ДК, и В-клетки.
Высвобождение INF-y активирует NK и нейтрофилы, стимулирует микробицидную активность макрофагов и индуцирует формирование гранулем, которые играют барьерную функцию для сдерживания внутриклеточных патогенов. Оба типа 1 и 2 интерферонов активируют NK клетки для уничтожения инфицированных вирусом клеток и высвобождения цитокинов.
При проникновении в организм патогенов происходит активация макрофагов и ДК, которые начинают секретировать IL-12, TNF-a, IL-18, IL-1. IL-12 и IL-18 стимулируют выработку INF-y NK клетками и Т-лимфоцитами. INF-y с IL-12 индуцируют дифференцировку CD4 клеток в Th1, характеризующиеся способностью к продукции INF-y, IL-2 и лимфотоксина-a. Кроме того, INF-y способен ингибировать дифференцировку CD4′ клеток в Тп2 тип, синтезирующий IL-4, 5, 10, которые являются мощными ингибиторами цитокинов ТЫ типа.
INF-y также активирует макрофагальную микробицидную активность через индукцию TNF-a, реактивного кислорода и NO-интермедиатов и повышает экспрессию молекул МНС и рецепторов TNF-a. При различных инфекциях (Brucella abortus, Micobacterium fortuitum, C. albicans, Klebsiella pneumoniae) немаловажную защитную роль играют также нейтрофилы, активность которых усиливается под воздействием INF-y.
Дифференцировка клеток
Дифференцировка клеток — процесс реализации генетически обусловленной программы формирования специализированного фенотипа клеток, отражающего их способность к тем или иным профильным функциям. Иными словами, фенотип клеток есть результат координированной экспрессии (то есть согласованной функциональной активности) определённого набора генов.
В процессе дифференцировки менее специализированная клетка становится более специализированной. Например, моноцит развивается в макрофаг, промиобласт развивается в миобласт, который образуя синцитий, формирует мышечное волокно. Деление, дифференцировка и морфогенез— основные процессы, путём которых одиночная клетка (зигота) развивается в многоклеточный организм, содержащий самые разнообразные виды клеток. Дифференцировка меняет функцию клетки, её размер, форму и метаболическую активность.
Дифференцировка клеток происходит не только в эмбриональном развитии, но и во взрослом организме (при кроветворении, сперматогенезе, регенерации поврежденных тканей).
Содержание
Потентность
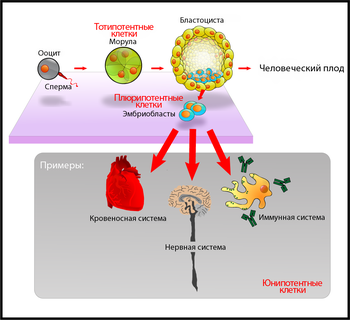

Общее название для всех клеток, ещё не достигших окончательного уровня специализации (то есть способных дифференцироваться), — стволовые клетки. Степень дифференцированости клетки (её «потенция к развитию») называется потентностью. Клетки, способные дифференцироваться в любую клетку взрослого организма, называются плюрипотентными. Для обозначения плюрипотентных клеток в организме животных используется также термин «эмбриональные стволовые клетки». Зигота и бластомеры являются тотипотентными, так как они могут дифференцироваться в любую клетку, в том числе и в экстраэмбриональные ткани.
Дифференцировка клеток млекопитающих
Самая первая дифференцировка в процессе развития эмбриона происходит на этапе формирования бластоцисты, когда однородные клетки морулы, разделяются на два клеточных типа: внутренний эмбриобласт и внешний трофобласт. Трофобласт участвует в имплантации эмбриона и дает начало эктодерме хориона (одна из тканей плаценты). Эмбриобласт даёт начало всем прочим тканям эмбриона. По мере развития эмбриона клетки становятся всё более специализированными (мультипотентные, унипотентные), пока не станут окончательно дифференцировавшимися клетками, обладающими конечной функцией, как например, мышечные клетки. В организме человека насчитывается порядка 220 различных типов клеток.
Небольшое количество клеток во взрослом организме сохраняют мультипотентность. Они используются в процессе естественного обновления клеток крови, кожи и др., а также для замещения повреждённых тканей. Так как эти клетки обладают двумя основными функциями стволовых клеток — способностью обновляться, поддерживая мультипотентность, и способностью дифференцироваться — их называют взрослыми стволовыми клетками.
Дедифференцировка
Дедифференцировка — это процесс, обратный дифференцировке. Частично или полностью дифференцировавшаяся клетка возвращается в менее дифференцированное состояние. Обычно является частью регенеративного процесса и чаще наблюдается у низших форм животных, а также у растений. Например, при повреждении части растения клетки, соседствующие с раной, дедифференцируются и интенсивно делятся, формируя каллус. При помещении в определённые условия клетки каллуса дифференцируются в недостающие ткани. Так при погружении черенка в воду из каллуса формируются корни. С некоторыми оговорками к явлению дедифференцировки можно отнести опухолевую трансформацию клеток.