Пернициозная анемия — болезнь со смертельным исходом, которую можно излечить витамином. Болезнь аддисона-бирмера Лечение анемии аддисона бирмера
Болезнь Аддисона
Общие сведения
Аддисонова болезнь представляет собой хроническую недостаточность функционирования коры надпочечников, проявляющуюся в снижении или прекращении секреции гормонов – минералокортикоидов и глюкокортикоидов (альдостерона, кортизола, кортизона, кортикостерона, дезоксикортикостерона и прочих кортикостероидов).
Недостаток гормонов минералокортикоидов приводит к повышению экскреции натрия и снижению экскреции калия, преимущественно с мочой, а также с потом и слюной, при этом электролитный дисбаланс вызывает тяжелую дегидратацию, гипертоничность плазмы, ацидоз, снижение объема циркулирующей крови, гипотензию и даже циркуляторный коллапс. Однако, если патология вызвана пониженной продукцией АКТГ, уровень электролитов остается нормальным или умеренно измененным. Тогда как недостаток глюкокортикоидов вызывает такие симптомы болезни Аддисона: изменения чувствительности к инсулину и нарушение углеводного, белкового и жирового метаболизма. В результате необходимые для жизнедеятельности углеводы образуются из белков, снижается уровень сахара в крови, истощаются запасы гликогена, откладываемые в печени, что выражается в общей, мышечной и в том числе миокардиальной слабости. У больных ухудшается сопротивляемость к вирусам и инфекциям, травмам и различным видам стресса. В процессе развития недостаточности снижается сердечный выброс, возникает циркуляторная недостаточность.
Если уровень плазменного кортизола понижен, то происходит стимуляция синтеза АКТГ и повышение уровня β-липотропного гормона, обладающего меланоцитостимулирующей активностью, которая вместе с тропином дает гиперпигментацию. У людей не только бронзовая кожа, но и слизистые. Это значит, что вторичная недостаточность, возникшая вследствие функциональных нарушений гипофиза, не проявляется в виде гиперпигментации.
Встречается это эндокринное расстройство достаточно редко – 4-6 человек на 100 тыс. в статистике разных стран. Оно впервые было описано английским врачом, отцом эндокринологии Томасом Аддисоном еще в 1855 году в книге «О конституциональных и местных последствиях заболеваний коры надпочечников».
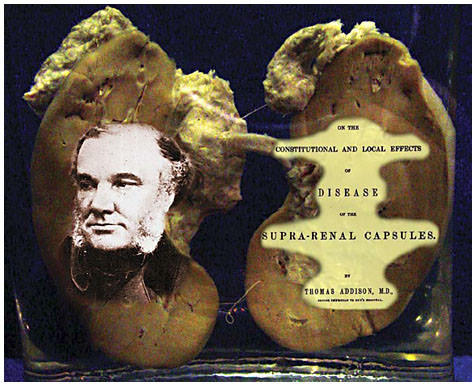
Томас Аддисон и его книга
Патогенез
Существует множество механизмов поражения коры надпочечников, вызывающих недостаточность выработки гормонов – гипокортицизм, или полное их отсутствие – акортицизм. К ним относят:
- аутоиммунные реакции (в 85 % случаев) – в организме синтезируются антитела к коре надпочечников — иммуноглобулины М, происходит лимфоидная инфильтрация, фиброз и атрофия функционирующих железистых клеток;
- инфекции – заносятся в надпочечники гематогенно, чаще всего провоцируют казеозный некроз и кальцификацию;
- недоразвитие (гипоплазия);
- онкология;
- генетические дефекты и заболевания, например, гемохроматоз;
- травмы;
- отравления;
- нарушение чувствительности или синтеза адренокортикотропного гормона (АКТГ) в результате ишемии, облучения и пр.
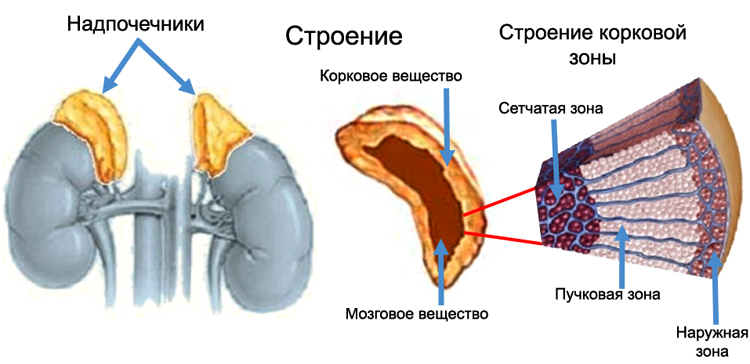
Гормоны коркового вещества надпочечников и их значение
Гормоны, продуцируемые в морфофункциональном корковом слое надпочечников являются кортикостероидами. Среди них наибольшую активность и значение имеют:
- Кортизол– глюкокортикоид, синтезируемый в пучковой зоне коркового слоя. Его главная функция – регуляция углеводного обмена, стимуляция глюконеогенеза и участие в развитие реакций стресса. Сохранение энергетических ресурсов реализуется по пути связывания кортизола с рецепторами печени и другими клетками-мишенями, что вызывает активацию синтеза глюкозы, запасание её в виде гликогена на фоне снижение катаболических процессов в мышцах.
- Кортизон– глюкокортикоид, второй по значению после кортизола, который способен стимулировать синтез углеводов и белков, угнетать органы иммунной системы, повышать устойчивость организма к стрессовым ситуациям.
- Альдостерон– главный минералокортикоид человека, синтезируется в клубочковой зоне корковой толщи, под его действием ткани способны удерживать воду, хлориды, усиливается реабсорбция натрия, экскреция калия, происходит сдвиг в сторону алкалоза, увеличивается кровяное давление и объемы циркулирующей крови.
- Кортикостерон – менее значимый минералокортикоидный гормон, имеет к тому же и глюкокортикоидную активность, хоть и в два раза меньшую, чем у кортизола, которая реализуется преимущественно в стимуляции глюконеогенеза печени.
- Дезоксикортикостеронявляется второстепенным малоактивным минералокортикостероидным гормоном, способным регулировать водно-солевой обмен, повышать силу и выносливость поперечно-полосатой мускулатуры.
Классификация
В зависимости от механизма развития Аддисоновой или по-другому бронзовой болезни выделяют:
- первичную недостаточность коры надпочечников – в основе патологии поражение непосредственно железистых структур;
- вторичную недостаточность – в результате нарушения гипоталомо-гипофизарной системы, которая в норме должна стимулировать кору надпочечников.
Острая недостаточность надпочечниковых желез называется гипоадреналовым или Аддисоновым кризом.
Особенности аддисонического криза
Развивается Аддисонический криз внезапно и может угрожать жизни человека. Низкие концентрации гормонов (кортизола, альдостерона) в кровотоке приводят к потере сознания или психозу, спутанности сознания, делирию, лихорадке, сильной рвоте и диареи, нарушениям минерального и водного баланса, болям в ногах, пояснице, животе, снижению АД и даже вызвать шок.
Причины
Аддисонова болезнь и гипофункция надпочечников может развиться в результате таких процессов и патологий как:
- туберкулезное, сифилитическое, бруцеллезное поражение;
- гнойное воспаление;
- снижение чувствительности или недостаточность АКТГ;
- прием экзогенных кортикостероидов, провоцирующий атрофию надпочечников;
- развитие негормонопродуцирующих опухолей;
- врожденная дисфункция;
- саркоидоз;
- амилоидоз;
- медикаментозная терапия, например, хлодатином, этомидатом, спиронолактоном, кетоконазолом, а также барбитуратами, блокаторами стероидогенеза.
Симптомы болезни Аддисона
Наиболее остро проявляется симптоматика Аддисоновой болезни в условиях стресса, когда происходит истощение симпатико-адреналовой системы и организм испытывает повышенную потребность в глюкокортикоидах. Патология развивается медленно и может быть не замечена в течение нескольких месяцев и даже лет, при этом она прогрессирует, и больной испытывает:
- хроническую усталость;
- мышечную слабость;
- повышенную раздражительность, тревожность, беспокойство, напряжение и вспыльчивость;
- депрессивное расстройство;
- жажду и необходимость в обильном питье;
- сильное сердцебиение и развитие тахикардии;
- изменения вкуса в пользу соленого и кислого;
- приливы тошноты, дисфагию (нарушения акта глотания), расстройства пищеварительной системы – рвоту, диарею, абдоминальные боли;
- теряет вес и утрачивает аппетит;
- обезвоживание организма и чрезмерное выделение мочи (полиурию);
- тетанию, паралич, тремор и судороги, особенно после употребления молочной продукции и накапливающихся в результате фосфатов;
- парестезии и ухудшение чувствительности конечностей;
- понижение уровня глюкозы в кровотоке (гипогликемию);
- уменьшение количества циркулирующей крови (гиповолемию).
Кроме того, развивается артериальная и достаточно часто — ортостатическая гипотензия. У женщин со стороны половой системы истощение надпочечников вызывает сбои менструального цикла, у мужчин – наблюдается эректильная дисфункция.
Важно! Одно из самых специфических проявлений заболевания, описанного Аддисоном – гиперпигментация кожных покровов тех областей, которые подвергаются солнечному облучению или большему трению. Темные пятна – мелазмы возникают по всему телу и даже на деснах, поэтому патология еще известная, как бронзовая болезнь. Лишь у 10% больных нет этого симптома и такую патологию называют «Белый Аддисон».
Известна и другая патология, описанная Аддисоном и проявляющаяся в виде желтушности покровов — анемия Аддисона-Бирмера, развивается при дефиците витамина В12 и называется еще по-другому пернициозная анемия или злокачественное малокровие.
Болезнь Аддисона-Бирмера: симптомы и особенности
В основе патологии атрофия слизистых желудка и прекращение секреции фактора Касла. Чаще всего встречается у пожилых особ и людей старше 40 лет. Помимо аутоиммуного механизма, причиной может быть строгое вегетарианство, рак, гельминтоз, резекция желудка и энтерит.
Симптомы болезни Аддисона-Бирмера сводятся к жжению языка, чувствительности, сухости и воспалению слизистых, быстрой утомляемости, головокружению, мигрени, одышке, усиленному сердцебиению, сонливости днем и ночной бессоннице. При этом присоединяются диспепсические расстройства — анорексия, диарея. Очень часто больные обращаются за медицинской помощью со значительной анемизацией.
Анемия Аддисона-Бирмера лечиться введением инъекционно витамина В12, а также направлена на нормализацию уровня гемоглобина.
Анализы и диагностика
Чтобы подтвердить Аддисонову болезнь нужно провести:
- ультразвуковое исследование надпочечников для выявления очагов поражения, например при туберкулезе;
- анализ крови для определения уровня гормонов надпочечников (кортизола), АКТГ, глюкозы, калия, натрия, ренина;
- КТ надпочечников, которое позволяет обнаружить инфаркт надпочечников, уменьшение размеров, опухолевые метастазы, амилоидоз;
- МРТ головного мозга для изучения гипоталамо-гипофизарной области и обнаружения деструктивных, опухолевых или гранулематозных процессов.
Основанием для диагностирования Аддисонического криза является:
- понижение концентрации натрия в кровотоке ниже 130 ммоль/л, выделение с мочой – меньше 10 г в сутки;
- повышение концентрации калия в кровяном русле свыше 5 ммоль/л;
- падение соотношения ионов натрия к калию до 20 единиц (в норме 32);
- низкий уровень глюкозы;
- развитие ацидоза;
- высокие концентрации мочевины, остаточного азота в анализах плазмы крови.
Лечение
Основным способом лечения первичного гипокортицизма является гормональная заместительная терапия. Недостаток кортизола можно восполнить гидрокортизоном, а альдостерона — флудрокортизона ацетатом.
Кроме того, в ходе лечения важно устранить последствия обезвоживания, провести симптоматическую терапию – ликвидировать проявления сердечной и дыхательной недостаточности, в случае обнаружения инфекции — назначить антибактериальные препараты.
Пернициозная анемия ( Болезнь Аддисона-Бирмера , В12-дефицитная анемия )
Пернициозная анемия – нарушение красного ростка кроветворения, обусловленное недостатком в организме цианокобаламина (витамина В12). При В12-дефицитной анемии развивается циркуляторно-гипоксический (бледность, тахикардия, одышка), гастроэнтерологический (глоссит, стоматит, гепатомегалия, гастроэнтероколит) и неврологический синдромы (нарушение чувствительности, полиневриты, атаксия). Подтверждение пернициозной анемии производится по результатам лабораторных исследований (клинического и биохимического анализа крови, пунктата костного мозга). Лечение пернициозной анемии включает сбалансированную диету, внутримышечное введение цианокобаламина.
МКБ-10
Общие сведения
Пернициозная анемия – разновидность мегалобластной дефицитной анемии, развивающаяся при недостаточном эндогенном поступлении или усвоении в организме витамина В12. «Пернициозная» в переводе с латинского означает «опасная, гибельная»; в отечественной традиции такая анемия раньше называлась «злокачественным малокровием». В современной гематологии синонимами пернициозной анемии также служат В12-дефицитная анемия, болезнь Аддисона-Бирмера. Заболевание чаще возникает у лиц старше 40-50 лет, несколько чаще у женщин. Распространенность пернициозной анемии составляет 1%; вместе с тем, дефицитом витамина В12 страдает около 10% пожилых людей в возрасте старше 70 лет.
Причины пернициозной анемии
Ежесуточная потребность человека в витамине B12 равняется 1-5 мкг. Она удовлетворяется за счет поступления витамина с пищей (мясом, кисломолочными продуктами). В желудке под действием ферментов витамин В12 отделяется от пищевого белка, однако для усвоения и всасывания в кровь он должен соединиться с гликопротеином (фактором Касла) или другими связывающими факторами. Всасывание цианокобаламина в кровоток происходит в средней и нижней части подвздошной кишки. Последующий транспорт витамина В12 к тканям и гемопоэтическим клеткам осуществляется белками плазмы крови – транскобаламинами 1, 2, 3.
Развитие В12-дефицитной анемии может быть связано с двумя группами факторов: алиментарными и эндогенными. Алиментарные причины обусловлены недостаточным поступлением витамина В12 с пищей. Это может происходить при голодании, вегетарианстве и диетах с исключением животного белка.
Под эндогенными причинами подразумевается нарушение усвоения цианокобаламина вследствие дефицита внутреннего фактора Касла при его достаточном поступлении из вне. Такой механизм развития пернициозной анемии встречается при атрофическом гастрите, состоянии после гастрэктомии, образовании антител к внутреннему фактору Касла или париетальным клеткам желудка, врожденном отсутствии фактора.
Нарушение абсорбции цианокобаламина в кишечнике может отмечаться при энтерите, хроническом панкреатите, целиакии, болезни Крона, дивертикулах тонкого кишечника, опухолях тощей кишки (карциноме, лимфоме). Повышенное расходование цианокобаламина может быть связано с гельминтозами, в частности, дифиллоботриозом. Существуют генетические формы пернициозной анемии.
Всасывание витамина В12 нарушено у пациентов, перенесших резекцию тонкой кишки с наложением желудочно-кишечного анастомоза. Пернициозная анемия может быть ассоциирована с хроническим алкоголизмом, применением некоторых лекарственных средств (колхицина, неомицина, пероральных контрацептивов и др.). Поскольку в печени содержится достаточный резерв цианкобаламина (2,0-5,0 мг), пернициозная анемия развивается, как правило, только лишь спустя 4-6 лет после нарушения поступления или усвоения витамина В12.
В условиях недостаточности витамина В12 возникает дефицит его коферментных форм – метилкобаламина (участвует в нормальном протекании процессов эритропоэза) и 5-дезоксиаденозилкобаламина (участвует в метаболических процессах, протекающих в ЦНС и периферической нервной системе). Недостаток метилкобаламина нарушает синтез незаменимых аминокислот и нуклеиновых кислот, что приводит к расстройству образования и созревания эритроцитов (мегалобластному типу кроветворения). Они принимают форму мегалобластов и мегалоцитов, которые не выполняют кислородтранспортную функцию и быстро разрушаются. В связи с этим количество эритроцитов в периферической крови существенно сокращается, что приводит к развитию анемического синдрома.
С другой стороны, при дефиците кофермента 5-дезоксиаденозилкобаламина нарушается обмен жирных кислот, в результате чего накапливаются токсичные метилмалоновая и пропионовая кислоты, оказывающие непосредственное повреждающее действие на нейроны головного и спинного мозга. Кроме этого, нарушается синтез миелина, что сопровождается дегенерацией миелинового слоя нервных волокон – этим обусловлено поражение нервной системы при пернициозной анемии.
Симптомы пернициозной анемии
Тяжесть течения пернициозной анемии определяется выраженностью циркуляторно-гипоксического (анемического), гастроэнтерологического, неврологического и гематологического синдромов. Признаки анемического синдрома неспецифичны и являются отражением нарушения кислородтранспортной функции эритроцитов. Они представлены слабостью, снижением выносливости, тахикардией и ощущением сердцебиения, головокружением и одышкой при движении, субфебрилитетом. При аускультации сердца может выслушиваться шум «волчка» или систолические (анемические) шумы. Внешне отмечается бледность кожи с субиктеричным оттенком, одутловатость лица. Длительный «стаж» пернициозной анемии может приводить к развитию миокардиодистрофии и сердечной недостаточности.
Гастроэнтерологическими проявлениями В12-дефицитной анемии служат пониженный аппетит, неустойчивость стула, гепатомегалия (жировая дистрофия печени). Классический симптом, выявляемый при пернициозной анемии – «лакированный» язык малинового цвета. Характерны явления ангулярного стоматита и глоссита, жжение и болевые ощущения в языке. При проведении гастроскопии обнаруживаются атрофические изменения слизистой желудка, которые подтверждаются эндоскопической биопсией. Желудочная секреция резко снижается.
Неврологические проявления пернициозной анемии обусловлены поражением нейронов и проводящих путей. Больные указывают на онемение и скованность конечностей, мышечную слабость, нарушение походки. Возможно недержание мочи и кала, возникновение стойкого парапареза нижних конечностей. Осмотр невролога выявляет нарушение чувствительности (болевой, тактильной, вибрационной), повышение сухожильных рефлексов, симптомы Ромберга и Бабинского, признаки периферической полиневропатии и фуникулярного миелоза. При В12-дефицитной анемии могут развиваться психические нарушения – бессонница, депрессия, психозы, галлюцинации, деменция.
Диагностика пернициозной анемии
Кроме гематолога, к диагностике пернициозной анемии должны быть привлечены гастроэнтеролог и невролог. Дефицит витамина В12 (менее 100 пг/мл при норме 160-950 пг/мл) устанавливается при проведении биохимического исследования крови; возможно обнаружение Ат к париетальным клеткам желудка и к внутреннему фактору Касла. Для общего анализа крови типична панцитопения (лейкопения, анемия, тромбоцитопения). При микроскопии мазка периферической крови обнаруживаются мегалоциты, тельца Жолли и Кэбота. Исследование кала (копрограмма, анализ на яйца глистов) могут выявлять стеаторею, фрагменты или яйца широкого лентеца при дифиллоботриозе.
Проба Шиллинга позволяет определить нарушение всасывания цианокобаламина (по экскреции с мочой меченного радиоактивным изотопом витамина В12, принятого внутрь). Пункция костного мозга и результаты миелограммы отражают характерное для пернициозной анемии увеличение числа мегалобластов.
Для определения причин нарушения абсорбции витамина В12 в ЖКТ проводится ФГДС, рентгенография желудка, ирригография. В диагностике сопутствующих нарушений информативны ЭКГ, УЗИ органов брюшной полости, электроэнцефалография, МРТ головного мозга и др. В12-дефицитную анемию необходимо отличать от фолиеводефицитной, гемолитической и железодефицитной анемии.
Лечение пернициозной анемии
Установление диагноза пернициозной анемии означает, что пациент будет нуждаться в пожизненном патогенетическом лечении витамином В12. Кроме этого, показано регулярное (каждые 5 лет) проведение гастроскопии для исключения развития рака желудка.
С целью восполнения дефицита цианокобаламина назначаются внутримышечные инъекции витамина В12. Требуется коррекция состояний, приведших к В12-дефицитной анемии (дегельминтизация, прием ферментных препаратов, хирургическое лечение), а при алиментарном характере заболевания – диета с повышенным содержанием животного белка. При нарушении выработки внутреннего фактора Касла назначаются глюкокортикоиды. К гемотрансфузиям прибегают только при анемии тяжелой степени или признаках анемической комы.
На фоне терапии пернициозной анемии показатели крови обычно нормализуются через 1,5-2 месяца. Дольше всего (до 6 мес.) сохраняются неврологические проявления, а при поздно начатом лечении они становятся необратимыми.
Профилактика пернициозной анемии
Первым шагом на пути предотвращения пернициозной анемии должно стать полноценное питание, обеспечивающее достаточное поступление в организм витамина В12 (употребление мяса, яиц, печени, рыбы, молочных продуктов, сои). Необходима своевременная терапия патологий ЖКТ, нарушающих усвоение витамина. После хирургических вмешательств (резекции желудка или кишечника) необходимо проведение поддерживающих курсов витаминотерапии.
Больные с В12-дефицитной анемией входят в группу риска по развитию диффузного токсического зоба и микседемы, а также рака желудка, поэтому нуждаются в наблюдении эндокринолога и гастроэнтеролога.
Анемия Аддисона-Бирмера

Болезнь или анемию Аддисона-Бирмера часто путают с банальной В12-дефицитной анемией. Они похожи наличием неврологической симптоматики и мегалобластным кроветворением. Особенность, установленная независимо друг от друга англичанином Аддисоном и немцем Бирмером, в обязательной совокупности трех факторов:
- тяжелая форма атрофического гастрита;
- наличие дефицита витамина В12 из-за нарушения его усвоения, независимо от его количества в пищевых продуктах;
- переход кроветворения на мегалобластный вид, характерный для эмбрионального периода развития человека.
Другое название — пернициозная (злокачественная) анемия. Она встречается у 110–180 человек из 100 тыс. населения. Преимущественно в пожилом возрасте, после 60. Среди женщин немного чаще, чем среди мужчин. Некоторые исследователи уверяют, что болезнью Аддисона-Бирмера страдает до 1% лиц старших возрастных групп. Если имеется наследственная предрасположенность, то заболевают молодые и люди средних лет.
Причины
Аддисон описал клинические симптомы злокачественной анемии в 1855 году, Бирмер — спустя 13 лет. Оба считали болезнь неизлечимой, поскольку главные поражающие факторы не были известны.
Через 2 года после Бирмера была установлена связь анемии с атрофией слизистой на внутренней поверхности желудка и с прекращением продуцирования пепсиногена.
Дальнейшие исследования позволили уточнить характер и степень изменений в желудке. Оказалось, что атрофия захватывает 2/3 слизистой и «убивает» клетки, называемые париетальными. Вместе с ними теряется способность вырабатывать фермент. Погибшие клетки замещаются другими, которые очень напоминают кишечные по способности к выработке слизи.
Стенка желудка инфильтрируется лимфоцитами и плазмой. Важно, что подобные изменения наблюдаются не только при пернициозной анемии, но и при обычном течении атрофического гастрита. При этом у пациентов даже при длительном стаже болезни нет малокровия.
Оказалось, что для развития болезни Аддисона-Бирмера нужны еще 2 компонента:
- наследственная предрасположенность;
- аутоиммунная настройка организма.
Влияние иммунитета подтверждено выявлением методом иммунофлюоресценции двух типов антител в сыворотке крови у пациентов:
- к самим париетальным клеткам (у 90% пациентов);
- к внутреннему фактору, продуцирующему пепсиноген (у 57% больных).
Антитела обнаружены в 76% случаев и в желудочном соке, именно они препятствуют всасыванию витамина В12.
Современные представления об иммунитете позволили раскрыть более тонкие механизмы нарушения: наследственный характер подтвержден наличием антител у здоровых родственников. В результате сбоя контроля за работой иммунной системы одновременно появляются антитела против клеток щитовидной железы, надпочечников, клеток Лангерганса в поджелудочной железе.
Что является первичным, поражение желудка или аутоаллергия, пока неясно. Оба процесса усиливают друг друга, тормозят регенерацию слизистой.
Клиническая картина
Клинические проявления при болезни Аддисона-Бирмера начинаются обычно с общих симптомов малокровия, но обязательно сочетаются с нарушениями пищеварения и неврологическими симптомами. Пациенты жалуются на:
- повышенную утомляемость, сонливость, усталость;
- у ¼ имеются боли в языке или во рту;
- чувство тяжести после еды в эпигастральной зоне;
- около 1/3 случаев сопровождаются онемением, «ползанием мурашек» на коже ног и рук;
- возможно небольшое похудение, но чаще больные склонны к полноте;
- при обострении возможен частый понос, каловые массы интенсивно окрашены в связи со скоплением стеркобилина;
- повышение температуры вызывается усиленным распадом эритроцитов.
К редким симптомам относят:
- нарушенное мочеиспускание, импотенцию у мужчин;
- затруднение походки;
- зрительные расстройства.
Симптоматика поражения черепных нервов (зрительного, обонятельного, слухового) вызывает изменение восприятия: снижение обоняния, слуха, зрения.
Крайне редко отмечались нарушения психического состояния, галлюцинации.
Диагностика
При осмотре врач обнаруживает:
- бледность кожи;
- лицо одутловатое;
- коричневую пигментацию на носу и скулах;
- небольшую иктеричность склер.
Осмотр полости рта дает типичную картину:
- в начале заболевания язык выглядит «ошпаренным» с болезненными трещинами;
- участки воспаления, язвочки на деснах, слизистой рта с переходом на глотку и пищевод;
- в период разгара заболевания язык становится ярким, как будто лакированным, за счет атрофии и отека складок.
При пальпации живота определяется выступающий мягкий край печени, увеличение ее в размерах. Селезенка увеличивается редко.
Какое дополнительное обследование необходимо?
Сложность патологии предполагает участие в диагностике разных специалистов.
- Невролог проводит более сложное исследование, которое позволяет установить утраченную чувствительность в конечностях обычно с обеих сторон, измененные двигательные рефлексы, указывающие на поражения миелиновых оболочек спинного мозга.
- Для исключения вероятности раковой опухоли необходимо эндоскопическое исследование желудка. При атрофическом гастрите видны блестящие участки атрофии (перламутровые).
- На рентгеноскопии обращает на себя внимание ускорение эвакуации и сглаженность складок слизистой.
- Для подтверждения низкой всасываемости витамина В12 в желудке проводится тест Шиллинга: устанавливается количество выделенного витамина после введения внутреннего фактора. Обязательно проверяется соотношение снижения в крови и в моче. Низкий результат указывает на большое количество антител в желудочном соке.
- При анализе желудочного сока выявляют снижение концентрации или полное отсутствие соляной кислоты, много слизи.
- Гистологический анализ слизистой после биопсии указывает на истончение и потерю железистого эпителия. Для пернициозной анемии характерно полное отсутствие секреции гастромукопротеина и кислоты. Этот признак сохраняется в стадию ремиссии.
- На ЭКГ отмечаются проявления гипоксии миокарда, на фоне тахикардии возможны аритмии, признаки ишемии, раннего кардиосклероза. При длительной ремиссии и выздоровлении ЭКГ нормализуется.
Картина крови
Отсутствие витамина В12 приводит к нарушенному кроветворению в костном мозге. Гемоглобин снижается до 1,3 г %, а число эритроцитов падает еще интенсивнее, поэтому типична гиперхромия до 1,8 (одна клетка переполнена гемоглобином).
- В периферической крови обнаруживают крупные клетки эритроцитарного ряда: мегалоциты и макроциты, по размерам они в 2 раза больше нормального эритроцита. В центре отсутствует просветление. Возможно появление клеток с нарушенной структурой, остатками ядер, которые изменяют чувствительность к обычной окраске и приобретают необычный цвет.
- Количество ретикулоцитов падает. Если наблюдается рост, то это расценивается как благоприятный прогностический признак.
- Одновременно угнетается росток белой крови: появляется лейкопения со сдвигом вправо и относительным лимфоцитозом.
- Тромбоциты не только снижаются в количестве, но и растут в размерах. Кровоточивости с тромбоцитопенией не наблюдается.
- Костный мозг выглядит ярко-красным. В нем преобладают бластные клетки эритроцитарного ряда разного возраста и степени дозревания. Ученые отмечают, что тип клеточных преобразований очень похож на изменения при злокачественных опухолях и лейкозах.
В фазу ремиссии костномозговое кроветворение приходит в нормальное русло. В отличии от гемолитической анемии распад эритроцитов происходит в костном мозге и является вторичным.
Лечение при пернициозной анемии
Для противодействия основным причинам болезни необходимо устранить дефицит витамина В12. При анемии Аддисона-Бирмера заменить его продуктами питания не удается. Необходимо введение больших доз лекарственных препаратов.
Через полгода некоторые пациенты могут отличаться потерей железа. Тогда им добавляются таблетированные формы железосодержащих препаратов кратким курсом.
Хорошим показателем лечения служит повышение числа ретикулоцитов, восстановление самочувствия. Улучшения следует ожидать уже к шестому дню. Существуют формулы, позволяющие рассчитать стандартный рост ретикулоцитарных клеток для объективной оценки состояния пациента.
На стабилизацию уходит в среднем до 1,5 месяца. Исчезают признаки: прекращаются парестезии, появляется сила в конечностях, не беспокоит головокружение.
Особенности течения
Сложности возникают при наличии клинических признаков, не подтвержденных изменениям кроветворения. В таких случаях ставится диагноз атрофического гастрита, а не болезни Аддисона-Бирмера.
Сомнения в правильном диагнозе появляются при плохой реакции на введение витамина В12, отсутствии неврологической симптоматики. Важно предусмотреть, что эффект лечения может быть уничтожен при имеющихся у пациента сопутствующих заболеваниях:
- хронического пиелонефрита;
- почечной недостаточности;
- любой длительной инфекции;
- болезней щитовидной железы;
- раковых опухолях.
Поэтому следует досконально обследовать больного. Показательно, что даже при отсутствии клинического результата кроветворение становится нормальным.
Прогноз
В современных условиях редко приходится видеть коматозную стадию пернициозной анемии. Такое возможно только при полном отсутствии лечения. Сейчас больные выздоравливают, но нуждаются в наблюдении и предупреждении ремиссии.
При длительном течении заболевания у пациентов обнаруживается сопутствующая типичная патология:
- в 1,8% случаев — диффузный токсический зоб;
- 2,4% страдают микседемой (и, наоборот, у 9% пациентов с гипотиреозом проявляется пернициозная анемия).
Начальными проявлениями рака считаются:
- нетипичное похудение;
- устойчивость к лечению Цианкобаламином;
- нормализацию кроветворения при неисчезающих симптомах.
Недостаточное изучение причин и последствий анемии Аддисона-Бирмера предполагает активное участие самого пациента в предупреждении рецидивов путем обеспечения качества питания, соблюдения диеты, устранения вредных привычек, своевременного лечения болезней желудка и кишечника. Для лечащего врача важно помнить об онкологической настороженности.
Что такое анемия Аддисона (пернициозная анемия)?
Анемия Аддисона также известна под такими названиями, как анемия Аддисона-Бирмера, первичная анемия, пернициозная анемия и пагубная анемия. Это – серьезное заболевание, которое относится к редким расстройствам нормальной функции крови и заключается в неспособности организма правильно использовать витамин В12, необходимый для развития красных кровяных клеток.
Открыто это заболевание было в 1855 году англичанином Т. Аддисоном, а спустя почти 20 лет немец А. Бирмер детально описал этот вид анемии. Таким образом, этому состоянию было решено присвоить название аддисоновой анемии.
Спустя почти 70 лет после открытия (в 1926 г.), врачи Мёрфи, Майнот и Уипл установили, что пернициозная анемия подлежит лечению сырой говяжьей печенью, и что основная причина заболевания – это невозможность желудочной поверхности вырабатывать специальное вещество для всасывания В12. В 1934 г. этим врачам была вручена Нобелевская премия за произведенное открытие.
Механизм развития и причины анемии Аддисона
Нервные клетки и клетки крови нуждаются в витамине В12, чтобы нормально функционировать. Этот витамин человек получает из таких пищевых продуктов, как мясо, птица, моллюски, яйца и молочные продукты. Специальный белок, называемый внутренним фактором, помогает кишечнику усваивать витамин В12. Этот белок выделяется клетками в желудке. Когда желудок не вырабатывает достаточное количество внутреннего фактора, кишечник не может правильно усваивать витамин В12.
В большинстве случаев анемия Аддисона развивается в результате отсутствия желудочного белка. Также известны такие описания этого заболевания:
- врожденная злокачественная анемия из-за дефицита внутреннего фактора;
- взрослая пагубная анемия;
- ювенальная кишечная мальабсорбция витамина В12.
Устаревшая форма этого состояния – злокачественное малокровие.
Общие причины анемии Аддисона:
- атрофический гастрит (ослабление функции внутренней поверхности желудка);
- аутоиммунное заболевание, при котором иммунная система организма атакует белок внутреннего фактора или клетки поверхности желудка, вырабатывающие его;
- в самых редких случаях анемия Аддисона-Бирмера передается по наследству. Тогда она называется врожденной злокачественной (пагубной) анемией.
У взрослых заболевание обычно проявляется после 60 лет.
Факторы риска развития анемии Аддисона
Вероятность получить данное заболевание выше у жителей Скандинавии или Северной Европы, а также у тех, в чьих семьях уже встречались подобные заболевания, и даже не в одном поколении. Дополнительные факторы, повышающие риск заболевания:
- хронический тиреоидит;
- болезнь Грейвса (токсический зоб, болезнь Перри);
- гипопаратиреоз (дефицит специфического паратгормона, отвечающего за обмен фосфора и калия в организме);
- гипопитуитаризм (практически полный отказ гипофиза от выработки гормонов);
- миастения (нервно-мышечная дисфункция, слабость мышц, человек с таким заболеванием не может поднимать тяжести);
- вторичная аменорея (из-за недостатка витаминов у женщин детородного возраста прекращается менструация);
- сахарный диабет 1 типа (инсулинозависимость);
- дисфункция яичек (следовательно, бесплодие);
- витилиго (заболевание кожи с нарушением пигментации, на поверхности тела появляются более светлые пятна, отличающиеся по цвету от основного тона).
Диагностика анемии Аддисона
Для окончательного диагноза необходимо провести полный спектр исследований, в частности:
- полный анализ крови;
- уровень витамина В12;
- уровень метилмалоновой кислоты;
- показатель уровня ретикулоцитов;
- тест Шиллинга (проба Шиллинга, при помощи которой можно узнать, как желудок усваивает В12);
- показатели билирубина;
- уровень холестерина;
- показатель щелочной фосфатазы лейкоцитов;
- мазок периферической крови;
- способность TIBC (железосвязывающая способность организма. Если она ниже 43 мкмоль /л, есть причины для беспокойства).
Симптомы анемии Аддисона-Бирмера
Основные симптомы такого вида анемии:
- повышенное чувство усталости;
- утомляемость;
- слабость, отсутствие концентрации;
- постоянная сонливость;
- периодическое расстройство желудка;
- тахикардия;
- болезненные ощущения в грудной клетке;
- аномальный желтый оттенок кожи.
Некоторые пациенты не испытывают никаких симптомов заболевания длительное время. Однако понять, что что-то не в порядке, можно, отметив наличие некоторых состояний. Например:
- желание съесть лёд или другие, не используемые в каждодневном рационе продукты и материалы (например, мел);
- диарея, сменяющаяся запором;
- бледность кожи;
- отекший, опухший язык и кровоточащие десны;
- одышка при любой физической активности.
Возможное повреждение нервной системы из-за недостатка В12 может выражаться в депрессивном состоянии, потере равновесия, онемении рук и ног и покалывании конечностей, спутанности сознания и проблемах с запоминанием.
Лечение анемии Аддисона, профилактика
Лечение зависит от причин появления этого вида анемии. Если они наследственные, необходим постоянный контроль рациона и периодические обследования в стационаре, а также поддержание нервной функции при помощи правильно подобранных препаратов.
Большинство пациентов устраняет проблему при помощи дополнительных курсов препаратов с В12, однако более эффективным методом избавления от анемии Аддисона является предотвращение (или профилактика) такого состояния.
Веганы могут использовать альтернативные источники белка – орехи, семена, авокадо, брокколи, а люди, находящиеся на обычном рационе, должны включать в рацион яйца, мясо птицы, морскую рыбу, молочные продукты (молоко, творог, натуральные йогурты без сахара).
Любое повреждение нервной системы, точнее, её нормальной функции, может быть необратимым для организма. При ощущении слабости, расстройствах стула, проблемах с кожей и сердечной деятельностью, можно принимать комплексы, содержащие В12 или употреблять этот витамин внутрь (ампулы, капсулы, таблетки).
У людей, занимающихся физическим трудом повышенной сложности, расход всех витаминов и ресурсов организма в целом намного выше, чем у людей с сидячей работой или тех, кто занят трудом интеллектуальным. Поэтому на фоне интенсивных тренировок у спортсменов-женщин часто возникает аменорея (прекращение менструаций), а у мужчин нарушается репродуктивная функция.
По материалам:
American Autoimmune Related Diseases Association, Inc.
NIH/National Heart, Lung and Blood Institute
Genetic and Rare Diseases (GARD) Information Center
Autoimmune Information Network, Inc.
European Society for Immunodeficiencies