Для анемии аддисона бирмера справедливо. Признаки, по которым можно выявить болезнь аддисона, и терапия патологии. Этиология и патогенез
Болезнь Аддисона
Общие сведения
Аддисонова болезнь представляет собой хроническую недостаточность функционирования коры надпочечников, проявляющуюся в снижении или прекращении секреции гормонов – минералокортикоидов и глюкокортикоидов (альдостерона, кортизола, кортизона, кортикостерона, дезоксикортикостерона и прочих кортикостероидов).
Недостаток гормонов минералокортикоидов приводит к повышению экскреции натрия и снижению экскреции калия, преимущественно с мочой, а также с потом и слюной, при этом электролитный дисбаланс вызывает тяжелую дегидратацию, гипертоничность плазмы, ацидоз, снижение объема циркулирующей крови, гипотензию и даже циркуляторный коллапс. Однако, если патология вызвана пониженной продукцией АКТГ, уровень электролитов остается нормальным или умеренно измененным. Тогда как недостаток глюкокортикоидов вызывает такие симптомы болезни Аддисона: изменения чувствительности к инсулину и нарушение углеводного, белкового и жирового метаболизма. В результате необходимые для жизнедеятельности углеводы образуются из белков, снижается уровень сахара в крови, истощаются запасы гликогена, откладываемые в печени, что выражается в общей, мышечной и в том числе миокардиальной слабости. У больных ухудшается сопротивляемость к вирусам и инфекциям, травмам и различным видам стресса. В процессе развития недостаточности снижается сердечный выброс, возникает циркуляторная недостаточность.
Если уровень плазменного кортизола понижен, то происходит стимуляция синтеза АКТГ и повышение уровня β-липотропного гормона, обладающего меланоцитостимулирующей активностью, которая вместе с тропином дает гиперпигментацию. У людей не только бронзовая кожа, но и слизистые. Это значит, что вторичная недостаточность, возникшая вследствие функциональных нарушений гипофиза, не проявляется в виде гиперпигментации.
Встречается это эндокринное расстройство достаточно редко – 4-6 человек на 100 тыс. в статистике разных стран. Оно впервые было описано английским врачом, отцом эндокринологии Томасом Аддисоном еще в 1855 году в книге «О конституциональных и местных последствиях заболеваний коры надпочечников».
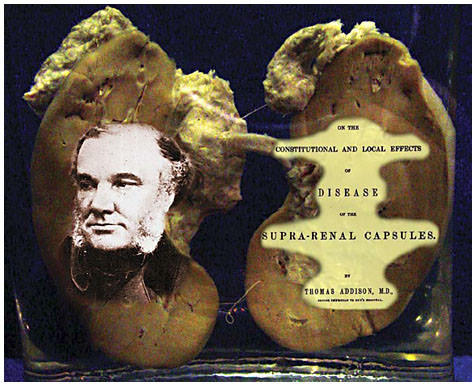
Томас Аддисон и его книга
Патогенез
Существует множество механизмов поражения коры надпочечников, вызывающих недостаточность выработки гормонов – гипокортицизм, или полное их отсутствие – акортицизм. К ним относят:
- аутоиммунные реакции (в 85 % случаев) – в организме синтезируются антитела к коре надпочечников — иммуноглобулины М, происходит лимфоидная инфильтрация, фиброз и атрофия функционирующих железистых клеток;
- инфекции – заносятся в надпочечники гематогенно, чаще всего провоцируют казеозный некроз и кальцификацию;
- недоразвитие (гипоплазия);
- онкология;
- генетические дефекты и заболевания, например, гемохроматоз;
- травмы;
- отравления;
- нарушение чувствительности или синтеза адренокортикотропного гормона (АКТГ) в результате ишемии, облучения и пр.
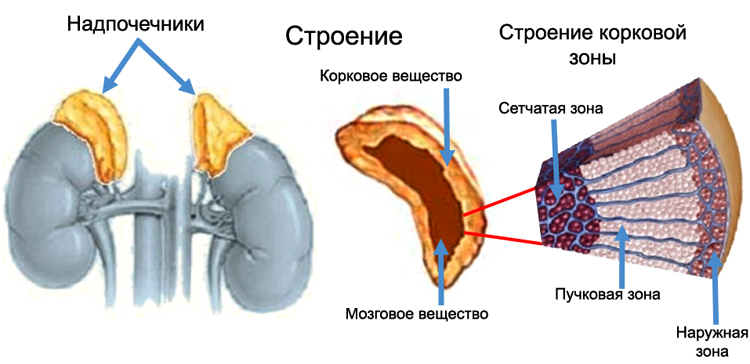
Гормоны коркового вещества надпочечников и их значение
Гормоны, продуцируемые в морфофункциональном корковом слое надпочечников являются кортикостероидами. Среди них наибольшую активность и значение имеют:
- Кортизол– глюкокортикоид, синтезируемый в пучковой зоне коркового слоя. Его главная функция – регуляция углеводного обмена, стимуляция глюконеогенеза и участие в развитие реакций стресса. Сохранение энергетических ресурсов реализуется по пути связывания кортизола с рецепторами печени и другими клетками-мишенями, что вызывает активацию синтеза глюкозы, запасание её в виде гликогена на фоне снижение катаболических процессов в мышцах.
- Кортизон– глюкокортикоид, второй по значению после кортизола, который способен стимулировать синтез углеводов и белков, угнетать органы иммунной системы, повышать устойчивость организма к стрессовым ситуациям.
- Альдостерон– главный минералокортикоид человека, синтезируется в клубочковой зоне корковой толщи, под его действием ткани способны удерживать воду, хлориды, усиливается реабсорбция натрия, экскреция калия, происходит сдвиг в сторону алкалоза, увеличивается кровяное давление и объемы циркулирующей крови.
- Кортикостерон – менее значимый минералокортикоидный гормон, имеет к тому же и глюкокортикоидную активность, хоть и в два раза меньшую, чем у кортизола, которая реализуется преимущественно в стимуляции глюконеогенеза печени.
- Дезоксикортикостеронявляется второстепенным малоактивным минералокортикостероидным гормоном, способным регулировать водно-солевой обмен, повышать силу и выносливость поперечно-полосатой мускулатуры.
Классификация
В зависимости от механизма развития Аддисоновой или по-другому бронзовой болезни выделяют:
- первичную недостаточность коры надпочечников – в основе патологии поражение непосредственно железистых структур;
- вторичную недостаточность – в результате нарушения гипоталомо-гипофизарной системы, которая в норме должна стимулировать кору надпочечников.
Острая недостаточность надпочечниковых желез называется гипоадреналовым или Аддисоновым кризом.
Особенности аддисонического криза
Развивается Аддисонический криз внезапно и может угрожать жизни человека. Низкие концентрации гормонов (кортизола, альдостерона) в кровотоке приводят к потере сознания или психозу, спутанности сознания, делирию, лихорадке, сильной рвоте и диареи, нарушениям минерального и водного баланса, болям в ногах, пояснице, животе, снижению АД и даже вызвать шок.
Причины
Аддисонова болезнь и гипофункция надпочечников может развиться в результате таких процессов и патологий как:
- туберкулезное, сифилитическое, бруцеллезное поражение;
- гнойное воспаление;
- снижение чувствительности или недостаточность АКТГ;
- прием экзогенных кортикостероидов, провоцирующий атрофию надпочечников;
- развитие негормонопродуцирующих опухолей;
- врожденная дисфункция;
- саркоидоз;
- амилоидоз;
- медикаментозная терапия, например, хлодатином, этомидатом, спиронолактоном, кетоконазолом, а также барбитуратами, блокаторами стероидогенеза.
Симптомы болезни Аддисона
Наиболее остро проявляется симптоматика Аддисоновой болезни в условиях стресса, когда происходит истощение симпатико-адреналовой системы и организм испытывает повышенную потребность в глюкокортикоидах. Патология развивается медленно и может быть не замечена в течение нескольких месяцев и даже лет, при этом она прогрессирует, и больной испытывает:
- хроническую усталость;
- мышечную слабость;
- повышенную раздражительность, тревожность, беспокойство, напряжение и вспыльчивость;
- депрессивное расстройство;
- жажду и необходимость в обильном питье;
- сильное сердцебиение и развитие тахикардии;
- изменения вкуса в пользу соленого и кислого;
- приливы тошноты, дисфагию (нарушения акта глотания), расстройства пищеварительной системы – рвоту, диарею, абдоминальные боли;
- теряет вес и утрачивает аппетит;
- обезвоживание организма и чрезмерное выделение мочи (полиурию);
- тетанию, паралич, тремор и судороги, особенно после употребления молочной продукции и накапливающихся в результате фосфатов;
- парестезии и ухудшение чувствительности конечностей;
- понижение уровня глюкозы в кровотоке (гипогликемию);
- уменьшение количества циркулирующей крови (гиповолемию).
Кроме того, развивается артериальная и достаточно часто — ортостатическая гипотензия. У женщин со стороны половой системы истощение надпочечников вызывает сбои менструального цикла, у мужчин – наблюдается эректильная дисфункция.
Важно! Одно из самых специфических проявлений заболевания, описанного Аддисоном – гиперпигментация кожных покровов тех областей, которые подвергаются солнечному облучению или большему трению. Темные пятна – мелазмы возникают по всему телу и даже на деснах, поэтому патология еще известная, как бронзовая болезнь. Лишь у 10% больных нет этого симптома и такую патологию называют «Белый Аддисон».
Известна и другая патология, описанная Аддисоном и проявляющаяся в виде желтушности покровов — анемия Аддисона-Бирмера, развивается при дефиците витамина В12 и называется еще по-другому пернициозная анемия или злокачественное малокровие.
Болезнь Аддисона-Бирмера: симптомы и особенности
В основе патологии атрофия слизистых желудка и прекращение секреции фактора Касла. Чаще всего встречается у пожилых особ и людей старше 40 лет. Помимо аутоиммуного механизма, причиной может быть строгое вегетарианство, рак, гельминтоз, резекция желудка и энтерит.
Симптомы болезни Аддисона-Бирмера сводятся к жжению языка, чувствительности, сухости и воспалению слизистых, быстрой утомляемости, головокружению, мигрени, одышке, усиленному сердцебиению, сонливости днем и ночной бессоннице. При этом присоединяются диспепсические расстройства — анорексия, диарея. Очень часто больные обращаются за медицинской помощью со значительной анемизацией.
Анемия Аддисона-Бирмера лечиться введением инъекционно витамина В12, а также направлена на нормализацию уровня гемоглобина.
Анализы и диагностика
Чтобы подтвердить Аддисонову болезнь нужно провести:
- ультразвуковое исследование надпочечников для выявления очагов поражения, например при туберкулезе;
- анализ крови для определения уровня гормонов надпочечников (кортизола), АКТГ, глюкозы, калия, натрия, ренина;
- КТ надпочечников, которое позволяет обнаружить инфаркт надпочечников, уменьшение размеров, опухолевые метастазы, амилоидоз;
- МРТ головного мозга для изучения гипоталамо-гипофизарной области и обнаружения деструктивных, опухолевых или гранулематозных процессов.
Основанием для диагностирования Аддисонического криза является:
- понижение концентрации натрия в кровотоке ниже 130 ммоль/л, выделение с мочой – меньше 10 г в сутки;
- повышение концентрации калия в кровяном русле свыше 5 ммоль/л;
- падение соотношения ионов натрия к калию до 20 единиц (в норме 32);
- низкий уровень глюкозы;
- развитие ацидоза;
- высокие концентрации мочевины, остаточного азота в анализах плазмы крови.
Лечение
Основным способом лечения первичного гипокортицизма является гормональная заместительная терапия. Недостаток кортизола можно восполнить гидрокортизоном, а альдостерона — флудрокортизона ацетатом.
Кроме того, в ходе лечения важно устранить последствия обезвоживания, провести симптоматическую терапию – ликвидировать проявления сердечной и дыхательной недостаточности, в случае обнаружения инфекции — назначить антибактериальные препараты.
Анемия Аддисона-Бирмера

Болезнь или анемию Аддисона-Бирмера часто путают с банальной В12-дефицитной анемией. Они похожи наличием неврологической симптоматики и мегалобластным кроветворением. Особенность, установленная независимо друг от друга англичанином Аддисоном и немцем Бирмером, в обязательной совокупности трех факторов:
- тяжелая форма атрофического гастрита;
- наличие дефицита витамина В12 из-за нарушения его усвоения, независимо от его количества в пищевых продуктах;
- переход кроветворения на мегалобластный вид, характерный для эмбрионального периода развития человека.
Другое название — пернициозная (злокачественная) анемия. Она встречается у 110–180 человек из 100 тыс. населения. Преимущественно в пожилом возрасте, после 60. Среди женщин немного чаще, чем среди мужчин. Некоторые исследователи уверяют, что болезнью Аддисона-Бирмера страдает до 1% лиц старших возрастных групп. Если имеется наследственная предрасположенность, то заболевают молодые и люди средних лет.
Причины
Аддисон описал клинические симптомы злокачественной анемии в 1855 году, Бирмер — спустя 13 лет. Оба считали болезнь неизлечимой, поскольку главные поражающие факторы не были известны.
Через 2 года после Бирмера была установлена связь анемии с атрофией слизистой на внутренней поверхности желудка и с прекращением продуцирования пепсиногена.
Дальнейшие исследования позволили уточнить характер и степень изменений в желудке. Оказалось, что атрофия захватывает 2/3 слизистой и «убивает» клетки, называемые париетальными. Вместе с ними теряется способность вырабатывать фермент. Погибшие клетки замещаются другими, которые очень напоминают кишечные по способности к выработке слизи.
Стенка желудка инфильтрируется лимфоцитами и плазмой. Важно, что подобные изменения наблюдаются не только при пернициозной анемии, но и при обычном течении атрофического гастрита. При этом у пациентов даже при длительном стаже болезни нет малокровия.
Оказалось, что для развития болезни Аддисона-Бирмера нужны еще 2 компонента:
- наследственная предрасположенность;
- аутоиммунная настройка организма.
Влияние иммунитета подтверждено выявлением методом иммунофлюоресценции двух типов антител в сыворотке крови у пациентов:
- к самим париетальным клеткам (у 90% пациентов);
- к внутреннему фактору, продуцирующему пепсиноген (у 57% больных).
Антитела обнаружены в 76% случаев и в желудочном соке, именно они препятствуют всасыванию витамина В12.
Современные представления об иммунитете позволили раскрыть более тонкие механизмы нарушения: наследственный характер подтвержден наличием антител у здоровых родственников. В результате сбоя контроля за работой иммунной системы одновременно появляются антитела против клеток щитовидной железы, надпочечников, клеток Лангерганса в поджелудочной железе.
Что является первичным, поражение желудка или аутоаллергия, пока неясно. Оба процесса усиливают друг друга, тормозят регенерацию слизистой.
Клиническая картина
Клинические проявления при болезни Аддисона-Бирмера начинаются обычно с общих симптомов малокровия, но обязательно сочетаются с нарушениями пищеварения и неврологическими симптомами. Пациенты жалуются на:
- повышенную утомляемость, сонливость, усталость;
- у ¼ имеются боли в языке или во рту;
- чувство тяжести после еды в эпигастральной зоне;
- около 1/3 случаев сопровождаются онемением, «ползанием мурашек» на коже ног и рук;
- возможно небольшое похудение, но чаще больные склонны к полноте;
- при обострении возможен частый понос, каловые массы интенсивно окрашены в связи со скоплением стеркобилина;
- повышение температуры вызывается усиленным распадом эритроцитов.
К редким симптомам относят:
- нарушенное мочеиспускание, импотенцию у мужчин;
- затруднение походки;
- зрительные расстройства.
Симптоматика поражения черепных нервов (зрительного, обонятельного, слухового) вызывает изменение восприятия: снижение обоняния, слуха, зрения.
Крайне редко отмечались нарушения психического состояния, галлюцинации.
Диагностика
При осмотре врач обнаруживает:
- бледность кожи;
- лицо одутловатое;
- коричневую пигментацию на носу и скулах;
- небольшую иктеричность склер.
Осмотр полости рта дает типичную картину:
- в начале заболевания язык выглядит «ошпаренным» с болезненными трещинами;
- участки воспаления, язвочки на деснах, слизистой рта с переходом на глотку и пищевод;
- в период разгара заболевания язык становится ярким, как будто лакированным, за счет атрофии и отека складок.
При пальпации живота определяется выступающий мягкий край печени, увеличение ее в размерах. Селезенка увеличивается редко.
Какое дополнительное обследование необходимо?
Сложность патологии предполагает участие в диагностике разных специалистов.
- Невролог проводит более сложное исследование, которое позволяет установить утраченную чувствительность в конечностях обычно с обеих сторон, измененные двигательные рефлексы, указывающие на поражения миелиновых оболочек спинного мозга.
- Для исключения вероятности раковой опухоли необходимо эндоскопическое исследование желудка. При атрофическом гастрите видны блестящие участки атрофии (перламутровые).
- На рентгеноскопии обращает на себя внимание ускорение эвакуации и сглаженность складок слизистой.
- Для подтверждения низкой всасываемости витамина В12 в желудке проводится тест Шиллинга: устанавливается количество выделенного витамина после введения внутреннего фактора. Обязательно проверяется соотношение снижения в крови и в моче. Низкий результат указывает на большое количество антител в желудочном соке.
- При анализе желудочного сока выявляют снижение концентрации или полное отсутствие соляной кислоты, много слизи.
- Гистологический анализ слизистой после биопсии указывает на истончение и потерю железистого эпителия. Для пернициозной анемии характерно полное отсутствие секреции гастромукопротеина и кислоты. Этот признак сохраняется в стадию ремиссии.
- На ЭКГ отмечаются проявления гипоксии миокарда, на фоне тахикардии возможны аритмии, признаки ишемии, раннего кардиосклероза. При длительной ремиссии и выздоровлении ЭКГ нормализуется.
Картина крови
Отсутствие витамина В12 приводит к нарушенному кроветворению в костном мозге. Гемоглобин снижается до 1,3 г %, а число эритроцитов падает еще интенсивнее, поэтому типична гиперхромия до 1,8 (одна клетка переполнена гемоглобином).
- В периферической крови обнаруживают крупные клетки эритроцитарного ряда: мегалоциты и макроциты, по размерам они в 2 раза больше нормального эритроцита. В центре отсутствует просветление. Возможно появление клеток с нарушенной структурой, остатками ядер, которые изменяют чувствительность к обычной окраске и приобретают необычный цвет.
- Количество ретикулоцитов падает. Если наблюдается рост, то это расценивается как благоприятный прогностический признак.
- Одновременно угнетается росток белой крови: появляется лейкопения со сдвигом вправо и относительным лимфоцитозом.
- Тромбоциты не только снижаются в количестве, но и растут в размерах. Кровоточивости с тромбоцитопенией не наблюдается.
- Костный мозг выглядит ярко-красным. В нем преобладают бластные клетки эритроцитарного ряда разного возраста и степени дозревания. Ученые отмечают, что тип клеточных преобразований очень похож на изменения при злокачественных опухолях и лейкозах.
В фазу ремиссии костномозговое кроветворение приходит в нормальное русло. В отличии от гемолитической анемии распад эритроцитов происходит в костном мозге и является вторичным.
Лечение при пернициозной анемии
Для противодействия основным причинам болезни необходимо устранить дефицит витамина В12. При анемии Аддисона-Бирмера заменить его продуктами питания не удается. Необходимо введение больших доз лекарственных препаратов.
Через полгода некоторые пациенты могут отличаться потерей железа. Тогда им добавляются таблетированные формы железосодержащих препаратов кратким курсом.
Хорошим показателем лечения служит повышение числа ретикулоцитов, восстановление самочувствия. Улучшения следует ожидать уже к шестому дню. Существуют формулы, позволяющие рассчитать стандартный рост ретикулоцитарных клеток для объективной оценки состояния пациента.
На стабилизацию уходит в среднем до 1,5 месяца. Исчезают признаки: прекращаются парестезии, появляется сила в конечностях, не беспокоит головокружение.
Особенности течения
Сложности возникают при наличии клинических признаков, не подтвержденных изменениям кроветворения. В таких случаях ставится диагноз атрофического гастрита, а не болезни Аддисона-Бирмера.
Сомнения в правильном диагнозе появляются при плохой реакции на введение витамина В12, отсутствии неврологической симптоматики. Важно предусмотреть, что эффект лечения может быть уничтожен при имеющихся у пациента сопутствующих заболеваниях:
- хронического пиелонефрита;
- почечной недостаточности;
- любой длительной инфекции;
- болезней щитовидной железы;
- раковых опухолях.
Поэтому следует досконально обследовать больного. Показательно, что даже при отсутствии клинического результата кроветворение становится нормальным.
Прогноз
В современных условиях редко приходится видеть коматозную стадию пернициозной анемии. Такое возможно только при полном отсутствии лечения. Сейчас больные выздоравливают, но нуждаются в наблюдении и предупреждении ремиссии.
При длительном течении заболевания у пациентов обнаруживается сопутствующая типичная патология:
- в 1,8% случаев — диффузный токсический зоб;
- 2,4% страдают микседемой (и, наоборот, у 9% пациентов с гипотиреозом проявляется пернициозная анемия).
Начальными проявлениями рака считаются:
- нетипичное похудение;
- устойчивость к лечению Цианкобаламином;
- нормализацию кроветворения при неисчезающих симптомах.
Недостаточное изучение причин и последствий анемии Аддисона-Бирмера предполагает активное участие самого пациента в предупреждении рецидивов путем обеспечения качества питания, соблюдения диеты, устранения вредных привычек, своевременного лечения болезней желудка и кишечника. Для лечащего врача важно помнить об онкологической настороженности.
Для анемии аддисона бирмера справедливо. Признаки, по которым можно выявить болезнь аддисона, и терапия патологии. Этиология и патогенез
Болезнь Бирмера (Аддиссона-Бирмера) или «злокачественная анемия» наиболее частая и лучше изученная форма дефицита витамина В12.
История болезни начинается описанием Аддиссоном (1885) «генуинной» анемии у хорошо питающихся лиц; о желудочных дегенеративных поражениях высказывал предположение Флинт (1860), что, в дальнейшем было подтверждено Fenwick (1870) на секционном материале, в то время как бескислотность, доказанная Cohn и Mehring уже в 1886 г. лишь спустя несколько десятков лет была признана в качестве обязательного симптома болезни.
Бирмеру мы обязаны анатомоклиническим описанием «злокачественной анемии» (1868—1872), хотя большинство рассмотренных им случаев видимо в действительности, составляли виды анемии за счет недостатка фолиевой кислоты (Castle, 1970).
Описание мегалобласта Эрлихом в 1908 г. заложило основу морфологического диагноза, увенчавшегося в дальнейшем практикой костномозговых пункций.
Начало патофизиологического этапа отмечено успешным применением пероральной гепатотерапии (Minot и Murphy), после чего, постепенно, путем очистки печеночных экстрактов, удалось выделить витамин В12 и синтезировать его. В 1938 г. Castle доказал роль внутреннего фактора в патогенезе этого заболевания. На последующих этапах были достигнуты большие успехи в изучении метаболизма витамина В12 и его взаимосвязь с другими метаболическими процессами, к тому же был приведен ряд аргументов, в пользу высказывания об аутоиммунном патогенезе с описанием нескольких генетических болезней, касающихся ферментов, которые зависят от витамина В12.
На основе современных знаний болезнь Бирмера можно определить как болезненное состояние, характеризующееся изменениями мегалобластического вида клеток периферической крови и костного мозга и дегенеративными поражениями слизистых оболочек пищеварительного тракта и нервной системы в связи с недостаточным поглощением витамина В12 по причине отсутствия внутреннего фактора, что, видимо создается каким-то аутоиммунным механизмом на наследственном фоне.
Частота заболевания значительно колеблется в зависимости от географической области при этом болезнь чаще в странах, населенных «северными расами» (Голландия, Скандинавский полуостров, Англия, США, Канада), чем на востоке и юге Европы и совсем редко встречается на Дальнем Востоке и среди негроз (Gummert). Более высокий показатель частоты у женского пола (5:2) не подтвержден всеми авторами.
По возрастным группам наиболее высокий показатель приходится на группу 45—55 лет, однако процент заболевших растет неуклонно в последующих группах.
Экономические и трудовые (профессиональные) условия не оказывают существенного влияния на показатель частоты этого заболевания «эндогенного детерминизма» (в отличие от мегалобластической анемии за счет недостатка фолиевой кислоты).
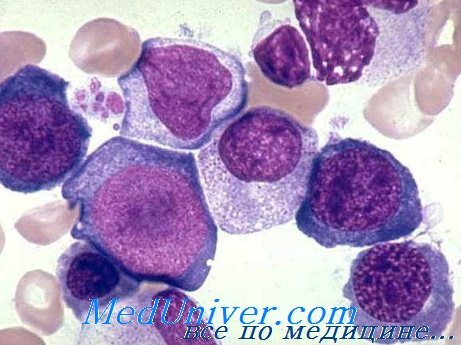
В болезни Бирмера роль строения и наследственности была выявлена при описании первых случаев (Аддисон). В дальнейшем высказывалось предположение о взаимосвязи с определенными соматическими, нервными или эндокринными строениями, была отмечена частота отдельных соматических черт (широкое лицо, отдаленные глаза, белесный цвет волос, раннее появление седины и пр.), которые, в, настоящее время, не считаются показательными.
Более важным представляется рост частоты полностью развившегося заболевания или его частичного проявления в семье больного.
По материалам Вернера (цит. Бегеманном), проводившего исследования в ряде семей страдающих, у 9% обследованных были отмечены иные явные случаи заболевания, а в 15% — частичные проявления [скрытые или исходные признаки болезни]. Среди близких родственников больного наиболее часто наблюдались заниженность или отсутствие кислотности (19%), желудочно-кишечные расстройства (33%), холе-цистопатия (15%) (реже — 8%—изменения языка), парестезия (25%) (в некоторых семьях наблюдалось развитие заболевания в сопровождении невропатии); из числа гематологических сдвигов отмечены мокроцитоз, овалицотоз, гиперсегментирование (примерно в 23% случаев).
Болезнь Бирмера описана и у одножелточных близнецов (Arbo и Mohr).
Другими аргументами, выступающими за генетический детерминизм болезни являются значительная частота антител против пристеночных клеток и сокращение ВФ у родственников больного (Ардеман и сотр.), также возможно, существенно увеличенная частота кровяной группы А (II) у страдающих бирмеровской анемией. К тому же выявлены (Асталди и сотр.,) количественные и качественныз изменения хромосом (непостоянные, нехарактерные).
По одному из предложенных генетических объяснений болезнь передается посредством гена, вовлеченного в процесс образования внутреннего фактора, при этом дефицит передается доминантным способом, но с небольшой проницаемостью; гомозитотное состояние видимо обусловливает ювенильную форму заболевания (при врожденном отсутствии внутреннего фактора), в то время как для проявления болезни в гетерозиготных условиях (обычной у взрослых) предполагается необходимым образование, во времени, атрофических поражений слизистой оболочки желудка (под воздействием каких-то эпигенетических факторов).
Вероятность наличия полигенетического механизма подсказывается относительно большой частотой случаев «конституционной гипохромной анемии» (с заниженным выделением желудочного сока, воспалением слизистой оболочки языка и пр.) среди родственников больного.
Второй основной вопрос патогенеза болезни Бирмера связан с нали чием аутоиммунных антител у большинства больных.
В сыворотке примерно 40% страдающих имеются антитела против ВФ, в то время как у примерно 90% — антитела против пристеночных клеток. Последние (примерно в размере 30% случаев) выявляются и при других заболеваниях аутоиммунного патогенеза, таких как тиреоз Хашимото, тиреотоксикоз, генуинная недостаточность надпочечной железы (Ирвине и сотр.). С другой стороны у 40—50% страдающих отмечается наличие противощитовидных антител.
Однако антитела против пристеночных клеток встречаются и при простом атрофическом гастрите (60%) или даже у лиц, страдающих невыявимыми заболеваниями (5—8%), особенно у женщин старше 60 лет (Ирвине и сотр.). Поставлен вопрос о том, не составляет ли развитие этих аутоантител вторичное явление изменению антител клеточных структур.
Антитела против внутреннего фактора находятся в разной пропорции в слюне и желудочном соке страдающих бирмеровской болезнью; их роль в сокращении поглощения витамина В1а доказана. Что касается роли антител против пристеночных клеток в патогенезе поражения слизистой оболочки желудка вопрос остается еще невыясненным (участвуют иммунологические механизмы гуморального и клеточного видов в обстановке разных эндо- и экзогенных факторов).
С диагностической точки зрения в случае мегалобластической анемии присутствие антител против пристеночных клеток указывает, с большой вероятностью, на наличие болезни Бирмера, в то время как выявление антител против внутреннего фактора свидетельствует о развитии этого заболевания почти с достоверностью (Williams).
Другим аргументом в пользу аутоиммунного патогенеза болезни Бирмера служит способность глюкокортикостероидов обусловливать (временно) регрессию поражений слизистой желудка и понижение коэффициента антител против внутреннего фактора (Robro и сотр.).
На сонове этих аргументов, выступающих, с одной стороны, за наследственный характер болезни, а с другой, за аутоиммунный фактор патогенеза в настоящее время многие авторы склонны рассматривать болезнь Бирмера как результат генетического недостатка, вызывающего иммунологическое нарушение, которое заключается в низкой иммуной переносимости в отношении клеток желудочного эпителия (и других клеток одинакового эмбриологического происхождения), в связи с чем проявляются аутоантитела (под воздействием добавочных факторов).
Анемия Аддисона-Бирмера
Существует несколько видов патологий, связанных с нехваткой микроэлементов в организме. Одна из них — анемия Аддисона Бирмера. Это злокачественное течение болезни, выражающееся анемия в дефиците витамина В12 и фолиевой кислоты. Заболевание, встречающееся в 30 – 50 случаях на 10000 населения, больше подвержены этому недугу женщины, причем, в возрасте старше 50 лет риск развития болезни возрастает (возможно это связано с менопаузой).
Классификация
Впервые анемия Аддисона Бирмера развивается при дефиците витамина B12, она была описана в 1855 году Аддисоном, позднее подтвердилась Бирмером, который изучил болезнь и дал подробное клиническое описание. Впоследствии, это состояние получило название по именам своих исследователей. Долгое время считалась заболеванием неизлечимым, протекающим тяжело и неудержимо. В настоящее время достаточно ясен патогенез заболевания, но этиология в большей мере остается лишь предположением.
Анемия Аддисона — Бирмера характеризуется наличием специфической триады нарушений в организме:
- Тяжелое течение гастрита по атрофическому типу. Происходит постепенное снижение функции железистого эпителия, слизистая инфильтрируется, замещается несвойственными данному органу клетками, выработка ферментов в крови резко сокращается или прекращается вовсе.
- Невозможность усвояемости витамина В12 и фолиевой кислоты. Оба компонента необходимы для построения клеток, с их помощью синтезируется ДНК и правильно формируется ядро клетки. При недостатке и того, и другого страдают, прежде всего, гемопоэз и нервная ткань.
- Развитие мегалобластного кроветворения. Это образование множества незрелых гранулоцитов крови, не способных нормально выполнять свои функции. В этом течение анемии Аддисона-Бирмера схоже со злокачественными болезнями крови.
Причины
Основным фактором, ведущим к развитию заболевания, причины анемии Аддисона Бирмера является атрофия слизистой оболочки желудка, в результате прекращается секреция (выработка) пепсиногена. А роль пепсиногена в организме такова, что он обеспечивает транспорт и всасывание цианкобаламина. Однако далеко не всегда атрофический гастрит ведет к развитию мегабластной анемии. Вероятно, для развития болезни должны совпасть несколько факторов.
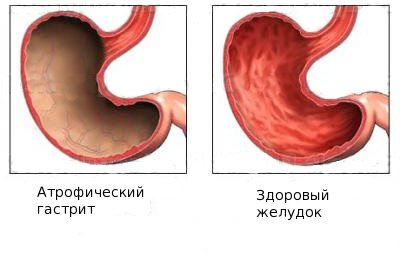 Атрофия слизистой желудка
Атрофия слизистой желудка
Усвоение В12 и фолиевой кислоты может нарушиться из-за обширного воспаления слизистой желудка и подвздошного отела кишечника или поражения их злокачественными опухолями.
Пернициозная анемия в, немалой степени, является аутоиммунным заболеванием, так в сыворотке крови пациентов в 70 -75% случаев выявлены антитела к внутренним клеткам желудка. При проведении опытов над крысами, выяснилось, что подобные клетки ведут к атрофии желудочной железистой ткани. Подобные антитела присутствуют и в желудочном секрете. Аутоиммунный ответ с высокой долей вероятности можно считать наследственным фактором, так как некоторое количество антител против париетальных клеток желудка, а так же клеток эндокринной системы обнаруживаются у здоровых родственников.
Дополнительным, но не менее важным фактором является наследственная склонность к заболеваниям поджелудочной железы.
Образ жизни, ведущий к сбоям в иммунной системе, например, экспериментирование с жесткими принципами диеты, резкий переход на вегетарианство, неконтролируемый прием медицинских препаратов, нарушение дозировок в приеме лекарств. Что важно, в послевоенные голодные годы заболеваемость пернициозной анемией не возрастала, а значит, недоедание количественное и качественное можно отнести лишь к сопутствующим причинам.
Поражение кишечника некоторыми паразитическими микроорганизмами и чрезмерное развитие патологической кишечной микрофлоры.
Существуют разрозненные факты по описанию случаев заболеваемости мегалобластной анемией. Например: в северных районах это патология встречается чаще; есть указания на увеличение заболеваемости у людей, чья работа связана со свинцом и возможностью медленного отравления окисью углерода; после операции по удалению желудка, когда происходит тотальная ликвидация секреторной функции, анемия способна развиться спустя 5-7 лет; есть сведения о развитии мегабластной анемии, как результате токсического отравления при хроническом алкоголизме.
Симптомы
Симптомы анемии Аддисона-Бирмера выглядит следующими образом, нарушается свертываемость крови, образуются эритроцитарные клетки аномальных размеров, с разросшейся цитоплазмой, а их ядра, содержат мелкие включения.
Из-за критической нехватки витамина В12 возникает дефект в метаболизме фолиевой кислоты, участвующей в синтезе ДНК. Как результат, нарушается деление клеток и понижается уровень эритроцитов на периферии. Таки же количественные и качественные деформации происходят и с тромбоцитами. Костный мозг изменяет окраску, приобретает насыщенный алый цвет, в нем преобладают мегабластные незрелые клетки, которые по типу развития напоминают злокачественное течение заболеваний крови.
Витамин В12 используется организмом не только для гемопоэза, но и для обеспечения нормальной работы нервной системы. При его недостатке наблюдается дистрофия в нервных окончаниях позвоночного столба.
Со стороны пищеварительной системы выявляется атрофия слизистой оболочки неба, глотки, пищевода, желудка и кишечника. Возможно образование полипов, небольшое увеличение печени. Клиника течения болезни анемии Аддисона-Бирмера проявляется постепенно: периодически возникает сильная слабость, хроническая усталость, усиливаются приступы головокружения, возникает шум в ушах.
Возникающие симптомы анемии Аддисона Бирмера можно разделить на проявления:
- со стороны нервной системы: нарушается регуляция движений, появляется парестезия; возникают боли в межреберье; иногда наблюдается поражение зрительного и слухового нерва; нарушение памяти.
- со стороны пищеварительного тракта: глоссит, характеризующийся синдромом «лакированного языка» и болезненные ощущения в языке; тошнота, тяжесть в области эпигастрия, формирование отвращения к пище, ухудшение вкусовых ощущений; увеличение печени, реже – селезенки, появление желтушности склер, слизистых оболочек;
- внешние проявления: холодные руки и ноги, бледная с желтоватым оттенком кожа, формируется характерный синдром анемии Аддисона-Бирмера – лицо восковой куклы; одутловатость лица, значительные отеки; вялость, сонливость.
- со стороны сердца: появление симптомов одышки, болей, дистрофических изменений в миокарде.
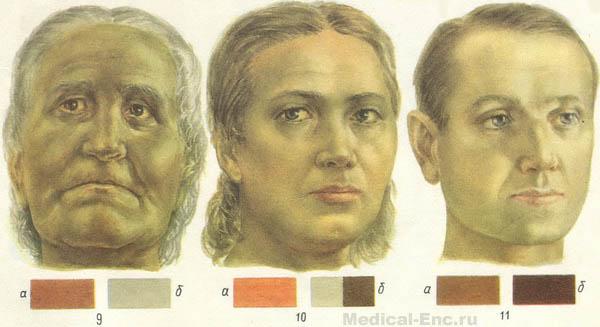 Лицо восковой куклы
Лицо восковой куклы
Диагностика
Диагностика анемии складывается из нескольких этапов.
Визуальный осмотр выявляет: бледные кожные покровы, желтушный оттенок склер, пигментные пятна на лице, руках и теле. Характерную картину дает осмотр ротовой полости, на начальной стадии заболевания язык болезненный, покрыт мелкими трещинками. В разгар болезни, язык приобретает алый цвет и отечность, выглядит, словно покрытый лаком. При проведении пальпации обнаруживается небольшое увеличение печени и выступление ее за край ребра. Селезенка увеличивается в размерах у небольшого количества пациентов. Проведение неврологических проб выявляет изменение чувствительности в конечностях.
При диагностике анемии Аддисона-Бирмера анализ крови играет ключевую роль. Проводится тщательное исследование периферической крови, где выявляется значительное повышение эритроцитарного объема крови, при этом количество ретикулоцитов резко снижено. Обнаруживается наличие гиперхромных эритроцитов. Главным признаком мегабластной анемии можно считать наличие гиперсегментарных нейтрофилов (имеющих пять и более сегментов в ядре). У человека относительно здорового таких клеток встречается в пределах 2%, у страдающих злокачественной анемией, количество гиперсегментарных нейтрофилов поднимается выше 5%.
Не менее важным является исследование костного мозга при анемии. В нем обнаруживается мегалобластный рост клеток – это остановившиеся в своем развитии клетки, предшествующие эритрацитам. Они аномально увеличены в размерах, деформированы, с заметной разницей в уровне развития ядра и цитоплазмы. Вообще, непродуктивный эритропоэз – характерная черта мегабластной анемии. Подавляющее число незрелых и деформированных клеток эритроцитов (мегабластов) разрушаются еще в костном мозге, не выходя в кровоток. При прогрессировании заболевания, количество ретикулоцитов продолжает падать, понижается количество тромбоцитов, при этом происходит их деформация.
Инструментальная диагностика включает в себя: исследование желудочного сока, где, как правило, выясняется снижение кислотности или полное ее отсутствие. Зато присутствует значительное количество слизи, схоже по составу с кишечной. Проводится эндоскопическое исследование, где явно наблюдается обширная атрофия слизистой оболочки желудка, часто называемая «перламутровыми бляшками», потеря секреторных клеток. К сожалению, даже в период ремиссии синтез пепсиногена не восстанавливается.
 Исследование желудочного сока
Исследование желудочного сока
Часто проводят гистологическое исследование тканей, так как одной из причин, способных вызвать анемию Аддисона Бирмера, являются злокачественные новообразования.
Таким больным требуется дополнительная консультация узких специалистов: невролога, эндокринолога, кардиолога, иммунолога.
Обязательным методом диагностики является проведение пробы Шиллинга. Этот метод нацелен на разграничение фолиево-дефицитной анемии от В12-дефицитной анемии для того, чтобы выявить первопричину, и наметить правильное лечение. Для этого измеряют их концентрацию в сыворотке крови. Норма фолиевой кислоты – 5-20нг/мл, норма В12 – 150-900нг/мл. Показатели ниже этих рамок свидетельствуют о наличии дефицита этих компонентов в организме. Чтобы провести пробу, больному вводят витамин В12 внутримышечно, через достаточное время определяют его концентрацию в моче, малое количество при В12-дефицитной анемии, максимальное – при фолиево-дефицитной.
Дефицит фолиевой кислоты в организме встречается чаще в молодом возрасте и не имеет сопутствующими факторами атрофию секреторной функции желудка и наличие неврологических симптомов. Она благоприятно реагирует на введение фолиевой кислоты перорально и лучше поддается лечению. При обследовании пациентов с В12-дефицитной анемией важно установить первопричину заболевания.
Лечение
Лечение анемии Аддисона Бирмера имеет свои особенности. Выбор лекарственного препарата зависит от причины заболевания. Фолиево-дефицитная анемия возникает из-за нарушения ее всасывания в кишечнике. Частой причиной этого вида анемии является хронический алкоголизм, причем особенно опасен он в период беременности.
Недостаток фолиевой кислоты более благоприятен для организма в плане лечения, так как при нем не страдает секреторная функция желудка, и введение перорально терапевтических доз препарата дает быстрый эффект.
Фолиевая кислота выпускается как отдельный препарат в форме таблеток или раствора для инъекций, так и в составе комплексных витаминов. Побочные эффекты при приеме фолиевой кислоты при лечении анемии возникают редко, но возможны аллергические реакции на внутримышечное введение препарата.
 Препараты фолиевой кислоты с витаминами
Препараты фолиевой кислоты с витаминами
В случае с дефицитом витамина В12 в организме, применение таблетированных форм не обоснованно, так как наличие атрофического гастрита сводит подобное лечение к нулю. В лечении этого вида анемии применяются внутримышечные или подкожные инъекции цианокобаламина. Внутривенное введение препарата опасно. Цианокобаламин – это жидкость розоватого цвета, в ампулах по 1мл, иногда его применение может вызвать аллергическую сыпь. Лекарство вводят ежедневно в дозе до 500мгк, в течение 6 недель, дополнительно вводят фолиевую кислоту в дозе до 100мгк.
При легкой или средней степени тяжести анемии, лечение, возможно, отложить до окончания полной диагностики и выявления причин дефицита. При выраженных неврологических нарушениях и значительных изменениях картины крови лечение начинают немедленно.
Часто, внешние признаки анемии Аддисона-Бирмера исчезают уже в первые дни лечения. Стихают боли в языке и ротовой полости, появляется аппетит, проходит слабость, восстанавливается зрение и слух. Через несколько суток восстанавливается ретикулоцитоз, количество мегабластов в костном мозге резко сокращается. Восстановление кроветворения происходит обычно через 1 -2 месяца. Тяжелые неврологические нарушения могут сохранять свою симптоматику в течение нескольких месяцев, а могут полностью и не исчезнуть вовсе.
При тяжелой атрофии слизистой желудка и при В12-дефицитной анемии препараты, содержащие витамин В12 приходится принимать всю жизнь. Пациент должен знать, что отказ от поддерживающей терапии влечет за собой рецидив мегалобластной анемии. Как правило, переболевшие анемией Аддисона-Бирмера ставятся на диспансерный учет и находятся под регулярным наблюдением. Поддерживающие дозы вводятся короткими курсами по назначению врача и под постоянным контролем картины крови.
Препараты для профилактики
В целях профилактики анемии фолиевую кислоту назначают лишь определенным группам граждан. Например, беременным женщинам для предотвращения патологий спинного мозга у плода, кормящим мама, для правильного развития ребенка. Пожилым людям при некоторых формах анемии, а так же пациентам, находящимся в коматозном состоянии. Во всех остальных случаях, достаточно того количества, которое поступает с пищей в обычном рационе.
Витамин В12 в целях профилактики назначают лишь при возможном его дефиците, например, при строгом вегетарианстве или тотальном удалении желудка. Цианокобаламин имеет широкую репутацию общеукрепляющего препарата, что совершенно не доказано, но его часто назначают при общем истощении, утомляемости и повышенной усталости как тонизирующее средство. Учитывая необходимость витаминов группы В в регуляции работы нервной системы, возможно применение цианокоболамина для лечения воспаления тройничного нерва и прочих нейропатиях.
Лечение анемии Аддисона Бирмера любыми витаминными препаратами должно быть строго нацеленным. И только если есть подозрение на дефицит нескольких витаминных компонентов, можно принимать поливитаминные комплексы.