Активированные т лимфоциты. Активность cd4 т-клеток воспаления. Т-клетки взяли под контроль
Активность CD4 Т-клеток воспаления
Для некоторых бактерий (возбудителей туберкулеза , лепры , чумы ) макрофаги являются “средой обитания”. Оказавшись в результате фагоцитоза в фаголизосомах , возбудители становятся защищенными как от антител , так и от цитотоксических T-лимфоцитов .
Подавляя активность лизосомальных ферментов, эти бактерии активно размножаются внутри клетки и становятся таким образом причиной острого инфекционного процесса. Неслучайно упомянутые в качестве примера заболевания относят к категории особо опасных инфекций.
В этой достаточно сложной ситуации в организме тем не менее имеются силы, препятствующие распространению возбудителей, и связаны они в первую очередь с CD4 Т-клетками воспаления .
Участие данного типа лимфоцитов в организации иммунного ответа реализуется через активацию макрофагов. Активированные макрофаги не только справляются с внутриклеточными патогенами, но и приобретают в ряде случаев дополнительные свойства, не связанные с антибактериальным действием, например, способность разрушать раковые клетки .
Для активации макрофагов требуется два сигнала.
Первый из них – интерферон-гамма (ИФ-гамма) . Это наиболее характерный цитокин , продуцируемый CD4 Т-клетками воспаления. Хелперные T-клетки не секретируют данный цитокин и не могут активировать макрофаги обычным путем.
Вторым сигналом для активации макрофагов служит поверхностный ФНО-альфа , который индуцируется к экспрессии после распознавания Т-клетками воспаления иммуногена на мембране макрофагов. Антитела к ФНО-альфа отменяют действие второго сигнала.
Цитотоксические T-клетки становятся активными сразу после распознавания антигена, реализуя потенциальную готовность молекулярного аппарата к уничтожению клеток-мишеней через процесс апоптоза или некроза . Напротив, CD4 Т-клетки воспаления после распознавания антигена на поверхности макрофагов тратят часы на синтез de novo медиаторов, активирующих макрофаги. Вновь синтезированные цитокины , собранные в микровезикулы, проникают в макрофаги в месте контакта с Т-клетками. Такой прямой путь, как и в случае с цитотоксическими Т-лимфоцитами, наиболее экономичен и функционально оправдан, поскольку не затрагивает соседние, неинфицированные клетки.
В макрофагах, активированных посредством контакта с Т-клетками воспаления и в результате секреции ИФ-гамма, инициируется ряд биохимических изменений, которые обеспечивают данным клеткам сильные антибактериальные свойства ( рис. 9.13 ). В условиях взаимодействия макрофагов с Т-клетками воспаления наблюдается более эффективное слияние фагосом , захвативших бактерии, с лизосомами – хранителями протеолитических ферментов, разрушающих внутриклеточные патогены. Процесс фагоцитоза сопровождается так называемым кислородным взрывом – образованием кислородных радикалов и окиси азота, обладающих бактерицидной активностью.
В условиях костимуляции ФНО-альфа и ИФ-гамма этот процесс идет гораздо активнее. Кроме того, активированные макрофаги усиливают экспрессию молекул II класса МНС и рецептора ФНО-альфа, что приводит к вовлечению дополнительных наивных Т-клеток . Весь этот комплекс событий обеспечивает достаточно прочный заслон от внутриклеточных патогенов.
Взаимодействующие с макрофагами Т-клетки воспаления не только способствуют усилению внутримакрофагальных биохимических процессов, но при этом сами активируются и выступают в роли организаторов многостороннего иммунного ответа на антиген.
Инфекционный процесс, провоцируемый воспроизводящимися патогенами, отражает борьбу двух сил – собственно возбудителя и иммунной системы хозяина. Например, возбудитель чумы Yersenia pestis обладает способностью к индуцируемому синтезу высокополимеризованного белка I , который начинает экспрессироваться на клеточной стенке при кислом значении рН. Известно, что в месте контакта возбудителя с макрофагом происходит локальное закисление. Это провоцирует синтез и экспрессию белка I. Данный белок, обладая сильными адгезивными свойствами, способствует более эффективному проникновению возбудителя внутрь клетки. Кроме того, это он помогает возбудителю избегать действия лизосомальных ферментов. Кислые условия фаголизосом поддерживают синтез этого защитного для возбудителя белка.
Макрофаги , хронически инфицированные внутриклеточными бактериями, могут терять способность активироваться Т-клетками. Массовое включение в процесс новых макрофагов происходит при высвобождении патогенов под влиянием синергического действия на инфицированные клетки ФНО-бета (лимфотоксина) и ИФ-гамма – продуктов активированных CD4 Т-клеток воспаления ( рис. 9.14 ).
Это сочетание цитокинов также эффективно для гибели фибробластов – основных компонентов соединительной ткани, что обеспечивает проникновение иммунокомпетентных клеток к месту локализации инфекции. Ясно, что в условиях мобилизации иммунного ответа пул эффекторных Т-клеток должен поддерживаться на высоком уровне. Активированные макрофагами Т-клетки воспаления вовлекают дополнительные эффекторы посредством ИЛ-2 , способствующего пролиферации и дифференцировке антигенспецифических Т-клеток.
Помимо Т-эффекторов рекрутируются и сами макрофаги. Это реализуется двумя способами:
– во-вторых, вновь образованные макрофаги под влиянием лимфотоксина и макрофагального хемотаксического фактора начинают миграцию из кровяного русла в очаг локализации инфекции, где они и оседают, испытывая на себе действие макрофагингибирующего фактора , снижающего их подвижность.
Набор цитокинов , продуцируемых активированными CD4 Т-клетками воспаления после специфического распознавания патогена, обеспечивает многопрофильное развитие клеточного иммунного ответа . Таким образом, клетки рассмотренной субпопуляции выступают в качестве организаторов адекватного иммунного ответа.
Цитотоксическая активность дендритных клеток против активированных cD4+ и cd8 Т-лимфоцитов в культуре in vitro Текст научной статьи по специальности «Фундаментальная медицина»
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Тыринова Тамара Викторовна, Леплина Ольга Юрьевна, Тихонова Марина Александровна, Останин Александр Анатольевич, Черных Елена Рэмовна
Целью настоящего исследования явилась сравнительная оценка цитотоксической активности IFNα-индуцированных дендритных клеток (ИФН-ДК) и IL-4-индуцированных ДК (ИЛ4-ДК) против активированных в алло-СКЛ CD4+ и CD8+ Т-лимфоцитов. Показано, что в культурах с ИФН-ДК доля AnnexinV+/PI’клеток, соответствующих ранней стадии апоптоза , среди CD4+Т-лимфоцитов была ниже, чем в культурах с ИЛ4-ДК. В то же время относительное количество AnnexinV+/PI+клеток (поздняя фаза апоптоза /некроз) среди CD4+Т-клеток после активации аллогенными ИФН-ДК и ИЛ4-ДК возрастало в равной степени. Продемонстрировано, что ИФН-ДК обладали сходной c ИЛ4-ДК способностью индуцировать апоптоз в CD3+CD8+Т-клетках.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Тыринова Тамара Викторовна, Леплина Ольга Юрьевна, Тихонова Марина Александровна, Останин Александр Анатольевич, Черных Елена Рэмовна
CYTOTOXIC ACTIVITY OF DENDRITIC CELLS AGAINST ACTIVATED CD4+ AND CD8+T-LYMPHOCYTES IN THE CULTURE IN VITRO
The aim of the present study was a comparative assessment of the cytotoxic activity of IFNα-induced dendritic cells (IFN-DCs) and IL-4-induced DCs (IL4-DCs) against allo-MLCactivated CD4+ and CD8+T-lymphocytes . It was shown the level of AnnexinV+/PI cells corresponding to early apoptosis among CD4+T-lymphocytes was lower in cultures with IFN-DCs compared with IL4-DCs. At the same time the relative number of AnnexinV+/ PI+ cells (late phase of apoptosis /necrosis) among CD4+T-lymphocytes activated by allogenic IFN-DCs and IL4-DCs increased in an equal degree. It was demonstrated that IFN-DCs possesed similar ability to induce apoptosis of CD3+ CD8+T-lymphocytes .
Текст научной работы на тему «Цитотоксическая активность дендритных клеток против активированных cD4+ и cd8 Т-лимфоцитов в культуре in vitro»
т.в. тыринова, о.Ю. Леплина, И.А. тихонова, А.А. останин, E.F. Черных
цитотоксичЕская активность дендритных клеток против активированных cD4+ и cD8 т-лимфоцитов в культуре in vitro
НИИ клинической иммунологии СО РАМН (Новосибирск)
Целью настоящего исследования явилась сравнительная оценка цитотоксической активности IFNa-индуцированных дендритных клеток (ИФН-ДК) и. IL-4-индуцированных ДК (ИЛ4-ДК) против активированных в алло-СКЛ CD4+ и CD8+ Т-лимфоцитов. Показано, что в культурах с ИФН-ДК доля AnnexinV+/PI’клеток, соответствующих ранней стадии апоптоза, среди CD4+Т-лимфоцитов была ниже, чем. в культурах с ИЛ4-ДК. В то же время относительное количество AnnexinV+/PI+клеток (поздняя фаза апоптоза/некроз) среди CD4+Т-клеток после активации аллогенными ИФН-ДК и ИЛ4-ДК возрастало в равной степени. Продемонстрировано, что ИФН-ДК обладали сходной c ИЛ4-ДК способностью индуцировать апоптоз в CD3+CD8+Т-клетках.
Ключевые слова: дендритные клетки, CD4+T-лимфоциты, CD8+T-лимфоциты, апоптоз
cytotoxic activity of dendritic cells against activated cD4+ and cd8+t-lymphocytes in the culture in vitro
T.V. Tyrinova, O.Yu. Leplina, M.A. Tihonova, A.A. Ostanin, E.R. Chernykh
Institute of Clinical Immunology SB RAMS, Novosibirsk
The aim. of the present study was a comparative assessment of the cytotoxic activity of IFNa-induced. dendritic cells (IFN-DCs) and IL-4-induced DCs (IL4-DCs) against allo-MLC- activated CD4+ and CD8+T-lymphocytes. It was shown the level of AnnexinV+/PI- cells corresponding to early apoptosis among CD4+T-lymphocytes was lower in cultures with IFN-DCs compared, with IL4-DCs. At the same time the relative number of AnnexinV+/ PI+ cells (late phase of apoptosis/necrosis) among CD4+T-lymphocytes activated, by allogenic IFN-DCs and IL4-DCs increased in an equal degree. It was demonstrated, that IFN-DCs possesed similar ability to induce apoptosis of CD3+CD8+T-lymphocytes.
Key words: dendritic cells, CD4+ T-lymphocytes, CD8+T-lymphocytes, apoptosis
Дендритные клетки (ДК), будучи профессиональными антигенпрезентирующими клетками, играют ведущую роль в запуске специфического противоопухолевого и противовирусного иммунного ответа, активируя наивные Т-клетки, эффекторные CD8+Т-клетки и индуцируя анти-генспецифический иммунный ответ [15]. С другой стороны, исследования последнего десятилетия демонстрируют, что ДК способны подавлять рост и пролиферацию опухолевых клеток за счет прямого цитостатического и цитотоксического эффектов, при этом не повреждая здоровые клетки [10].
Относительно недавно была описана популяция ДК, генерируемая в культуре in vitro в условиях замены IL-4 (ИЛ4-ДК) на IFN-a (ИФН-ДК). ИФН-ДК отличаются от ИЛ4-ДК более высокой миграционной активностью, выраженной антигенпрезентирующей функцией, большей стабильностью в условиях дефицита ростовых факторов, а также способностью стимулировать как Th1-, так и ^2-ответ [12]. Кроме того, ИФН-ДК являются более эффективными стимуляторами CD8+ эффекторных Т-клеток [5]. С точки зрения эффекторной функции ИФН-ДК характеризуются более высокой киллерной активностью против TRAIL-чувствительных опухолевых клеток Jurkat и схожей с ИЛ4-ДК цитотоксичностью против TRAIL-резистентных клеток-мишеней НЕр-2 [6].
Закономерно возникает вопрос, распространяется ли цитотоксический эффект ДК на иммунокомпетентные клетки. Согласно немногочисленным данным литературы в качестве клеток-мишеней цитотоксической активности ДК могут выступать активированные Т-лимфоциты. Поскольку Т-клетки могут экспрессировать рецепторы к цитотоксическим лигандам TNF- семейства (Fas, TRAIL-R1, TRAIL-R2, TNF-R1) [3], можно предположить, что иммунокомпетентные клетки действительно могут выступать в качестве потенциальных мишеней к цитотоксической активности ИФН-ДК.
Так, показано, что плазмацитоидные ДК (пДК) способны индуцировать апоптоз CD4+^ лимфоцитов ВИЧ-инфицированных больных через TRAIL-зависимый сигнальный путь [14]. Интересно отметить, что ВИЧ-стимулированные пДК также проявляют цитотоксическую активность против ФГА-активированных CD4+Т-клеток здоровых доноров. Эти данные позволяют предположить, что, с одной стороны, цитотоксическая активность ДК необходима для элиминации пораженных клеток, но, с другой стороны, может индуцировать гибель здоровых клеток и приводить к истощению T-клеток на ранней стадии заболевания. Недавние исследования показали, что миелоидные ДК участвуют в элиминации активированных, но не покоящихся CD4 + и CD8+Т-лимфоцитов, и данная функция опосреду-
ется через механизм FasL/Fas-индуцированного апоптоза [4].
Тем не менее, сведения о цитотоксическом эффекте ИФН-ДК против иммунокомпетентных клеток в сравнении с цитотоксической активностью миелоидных ДК, генерируемых в стандартном протоколе, практически отсутствуют. В связи с этим целью настоящего исследования явилась сравнительная оценка апоптоз-индуцирующей активности ИФН-ДК и ИЛ4-ДК против активированных CD4 + и CD8 + Т-лимфоцитов.
материалы и методы
В исследование были включены 15 здоровых доноров крови. Мононуклеарные клетки (МНК) выделяли центрифугированием гепаринизиро-ванной венозной крови в градиенте плотности фиколла-верографина. ИФН-ДК получали путем культивирования прилипающей фракции МНК в 6-луночных планшетах (Nunclon, Дания) в течение 3 — 4 сут. в среде RPMI-1640 (Sigma-Aldrich, США), дополненной 0,3 мг/мл L-глютамина, 5 мМ HEPES-буфера, 100 мкг/мл гентамицина и 2,5% сыворотки плодов коровы (БиолоТ, Санкт-Петербург) в присутствии GM-CSF (40 нг/мл, Sigma-Aldrich) и IFN-a (1000 Ед./мл, Роферон-А, Roche, Швейцария) с последующим дозреванием в течение 24 ч с липополисахаридом (10 мкг/мл, LPS Е. coli 0114:B4, Sigma-Aldrich). Для генерации ИЛ4-ДК прилипающую фракцию МНК инкубировали в полной культуральной среде в присутствии GM-CSF (40 нг/мл) и IL-4 (40 нг/мл, Sigma-Aldrich) в течение 5 суток. Конечное созревание ИЛ4-ДК индуцировали путем дополнительного культивирования клеток в течение 48 ч в присутствии ЛПС (10 мкг/мл).
Уровень апоптоза CD3 + CD4 + и CD3 + CD8 + Т-лимфоцитов оценивали в смешанной культуре лимфоцитов (СКЛ) при культивировании в течение 3 суток МНК доноров (0,1 х 106/лунку) в 96-луночных круглодонных планшетах в присутствии аллогенных ИФН-ДК в соотношении 10:1. Культуры дублировали в 12 идентичных повторах, с целью получения клеток в количестве, достаточном для проведения цитофлуориметри-ческого анализа. Для этого, 25 мкл МНК (1,0 х 106), полученных после культивирования в алло-СКЛ, инкубировали в течение 45 мин при 4 °С в темноте с 5 мкл АРС-коньюгированных анти-CD3-антител и 5 мкл PerCP-коньюгированных анти-CD4 (Becton Dickinson, США). После двукратной отмывки холодным забуференным физиологическим раствором, клетки суспендировали в 100 мкл 10Х-буфера (Becton Dickinson, США) и добавляли по 5 мкл An-nexin V-FITC и PI (Becton Dickinson, США). Клетки инкубировали в течение 15 мин в темноте при комнатной температуре, затем добавляли 400 мкл буфера 10X и измеряли на проточном цитофлуо-риметре FACS Calibur (Becton Dickinson, США).
Количество апоптотических клеток определяли по связыванию FITC-меченного Annexin V с клеточной мембраной (в диапазоне зеленого света) и PI с
ДНК клетки (в диапазоне красного света) в гейтах CD3+CD4+ или CD3+CD8+ (CD4-) Т-лимфоцитов. Количество клеток, находящихся в ранней стадии апоптоза, регистрировалось по связыванию с Annexin V-FITC и отсутствию связывания с PI. Флуоресценция клеток в обоих диапазонах свидетельствовала о поздней стадии апоптоза или о некрозе клетки. Жизнеспособные клетки соответствовали Annexin V-FITC’/PI’ зоне на цитограмме. Результаты выражались в виде процентного соотношения позитивных клеток к общему количеству CD3 + CD4 + , CD3+CD8 + Т-лимфоцитов. В каждом образце анализировали не менее 1 х 104 клеток; для обсчета результатов использовали программы Cell Quest.
Статистическую обработку данных проводили при помощи пакета прикладных программ Statistica 6.0 для Windows. Для выявления значимых различий сравниваемых показателей использовали непараметрический U-критерий Вилкоксона — Манна — Уитни. Различия считали достоверными при уровне значимости p
Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак
11 декабря 2015
Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак
- 3854
- 3,3
- 7
Автор
Редактор
Статья на конкурс «био/мол/текст»: Ученые объединили методы иммунотерапии, цитотерапии и генотерапии для перепрограммирования Т-лимфоцитов в потенциальных «убийц» раковых клеток. Но и этого оказалось недостаточно — следующим шагом стало создание молекулярного «выключателя», с помощью которого можно регулировать время и силу действия активированных Т-клеток. Инновационный метод закладывает основу для резкого сокращения серьезных (а иногда и смертельных) побочных эффектов, вызванных терапией с использованием модифицированных Т-клеток.
Обратите внимание!
Эта работа опубликована в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Медицина перешла на новый уровень: клетки стали живым лекарством
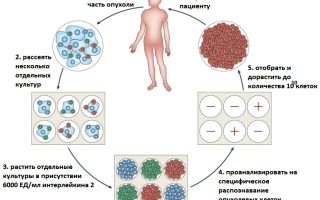
В последнее время в терапии опухолевых заболеваний особое внимание уделяется адоптивной иммуноцитотерапии (от англ. adoptive — приемный). При этом часть клеток иммунной системы пациента искусственно «натравливают» на опухолевые клетки. Суть метода состоит в том, чтобы отобрать у пациента необходимые иммунные клетки, обработать их — например, иммунными цитокинами (небольшими белками, выполняющими функции регуляторов деления и дифференцировки специфических иммунных клеток), — а затем вернуть в организм уже активированные клетки, которые и будут помогать бороться с опухолями* (рис. 1).
* — Эта тема является одной из самых горячих направлений клинической иммунологии — см. статью «Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль» [1]. — Ред.
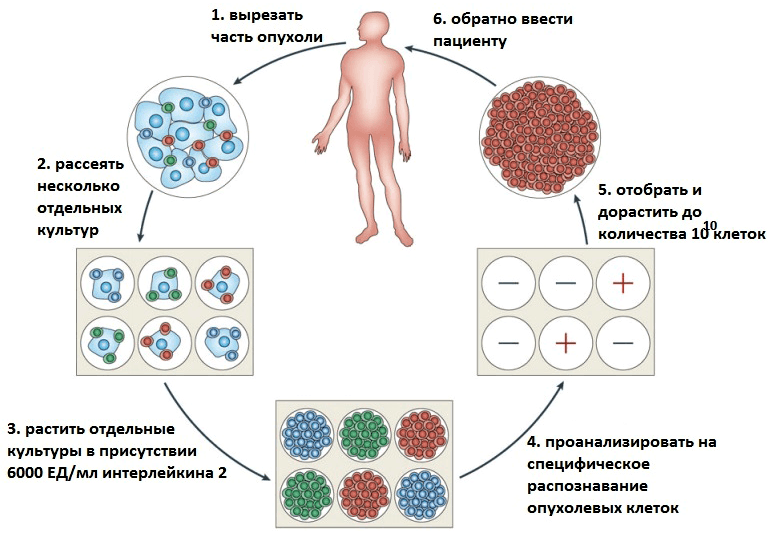
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Существует несколько вариантов клеток, которые используются в адоптивной иммунотерапии; из них три используются при терапии опухолевых заболеваний: уже знакомые нам TIL-клетки (лимфоциты, инфильтрующие опухоль), LAC-клетки (лимфокин-активированные киллеры) и CIK-клетки (цитокин-индуцированные киллеры). На самом деле собственные Т-клетки организма тоже стараются бороться с опухолевыми клетками, только зачастую опухолевые клетки им «не по зубам». Не то, чтобы совсем — ведь существует иммунный надзор, осуществляемый Т-клетками и естественными киллерами (NK-клетками), с помощью которых иммунная система старается защититься от опухолей, — однако это вовсе не стопроцентная защита. Однако случается, что иммунный надзор не всегда достаточно силен, чтоб предотвратить развитие опухолей: так, при длительном применении иммунодепрессантов после трансплантаций органов повышается частота развития многих опухолей [4].
Необходима система наведения
Несмотря на сложность получения модифицированных клеток, а также сопутствующий риск возникновения серьезных побочных эффектов, все же главной проблемой метода иммуноцитотерапии является отсутствие способов прицельной доставки вводимых модифицированных иммунных клеток в опухоль. Раковые клетки часто делаются практически «невидимыми» для иммунной системы, и они образуют микросреду, которая подавляет активность и миграцию Т-клеток [5]. Для того, чтобы сбросить мантию-невидимку с опухолевых клеток, Т-лимфоциты надо не только активировать, но и придать им способность прицельно узнавать опухолевые клетки. Т-клетки могут быть перепрограммированы методами генной инженерии путем введения генов, кодирующих рецепторы к опухолевым антигенам (TAA, tumour-associated аntigens) — оснащения собственной «системой наведения». Также можно заодно ввести гены для придания Т-клеткам устойчивости к иммуносупрессии для увеличения выживаемости или облегчения проникновения сконструированных Т-клеток в опухоль. В итоге, могут быть получены высокоактивные «наемные убийцы» раковых клеток [5].
Для получения эффективных «убийц» Т-лимфоциты модифицируют путем оснащения их искусственными химерными антигенными рецепторами (CAR, chimeric antigen receptors). Рецепторы химерные, поскольку одна часть (распознающая) была «позаимствована» у моноклональных антител, а часть, передающая сигнал, — у Т-клеточного рецептора (ТCR). В качестве внеклеточной «распознающей» части обычно служат вариабельные домены тяжелой и легкой цепи иммуноглобулинов необходимой специфичности (scFv), которые образуют специфичный к опухолевым клеткам антиген-связывающий участок [5] (рис. 2).
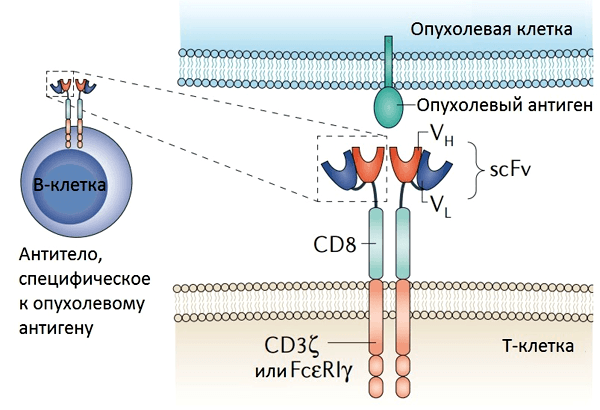
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
Однако с момента обнаружения химерных антигенных рецепторов до внедрения технологии в практику прошло больше 20 лет. За это время были улучшены химерные антигенные рецепторы — были созданы CAR 2-го поколения, в которые был внесен дополнительный сигнальный домен костимулирующей молекулы, который позволил улучшить активацию Т-клеток и их распространение. В CAR 3-го поколения был добавлен еще один сигнальный домен, что в конечном итоге повысило уровни выживания и размножения модифицированных Т-клеток [7] (рис. 3). В конечном итоге были улучшены способность к «выслеживанию» опухолевых клеток, а также уменьшены побочные эффекты.
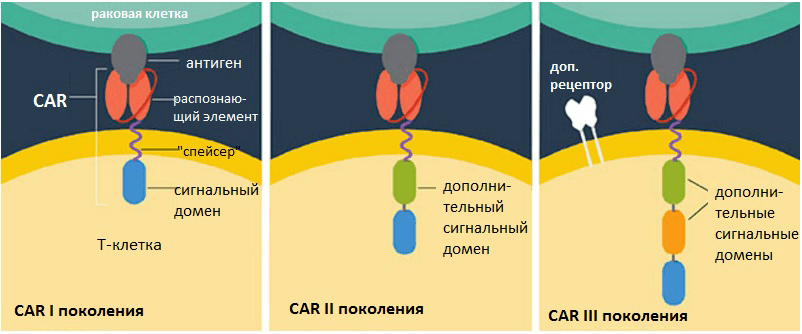
Рисунок 3. Эволюция химерных антигенных рецепторов. Рисунок с сайта www.the-scientist.com.

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Несмотря на то, что иммуноцитотерапия Т-клетками с CAR является прорывом в области лечения опухолевых заболеваний, есть еще ряд опасностей, которые могут поджидать за углом. Доктор Карл Джун (Carl June) из университета Пенсильвании был одним из первых, кто опубликовал успешные результаты лечения модифицированными Т-клетками, сравнил то, что происходит внутри тела пациента с «серийным убийством» и «массовым убийством». Когда миллиарды Т-клеток, которые были введены в организм, поделятся, то они смогут обнаружить и убить несколько фунтов опухоли. Но в этом тоже немало риска — многие пациенты страдают от синдрома высвобождения цитокинов (цитокинового шторма) — при борьбе Т-клетки с опухолевой клеткой высвобождается большое количество молекул цитокинов, что представляет угрозу для самого организма. Так, семь пациентов умерло вследствие этого синдрома [9].
Побочные эффекты связаны с мощной иммунной активностью модифицированных Т-клеток. Одним из камней преткновения является риск высокой токсичности, не позволяющий ввести подобное лечение на регулярной основе. «Т-клетки — действительно мощные создания», — говорит профессор Венделл Лим (Wendell Lim), заведующий отделом Департамента клеточной и молекулярной фармакологии Калифорнийского университета. — «Будучи активированными, они могут вызвать смерть. Нам необходима система удаленного контроля, которая сохранит силу этих модифицированных Т-клеток, и позволит специфично „общаться“ с ними и управлять Т-клетками, находящимися в организме» [10].
Т-клетки взяли под контроль
Ученые из Калифорнийского университета в Сан-Франциско создали молекулярный «включатель», с помощью которого можно управлять действиями генноинженерных Т-лимфоцитов. Как и обыкновенные Т-клетки, несущие CAR, новые Т-клетки с «включателем» будут взаимодействовать с опухолевыми клетками, но не будут переходить «в атаку», пока не будет введен специальный препарат. Данный препарат является своеобразным «химическим мостиком» внутри Т-клеток: он запускает иммунные реакции, «включает» их, переводя в активное состояние. Когда препарат перестает циркулировать в крови, Т-клетки снова переходят в «выключенное» состояние (рис. 5).
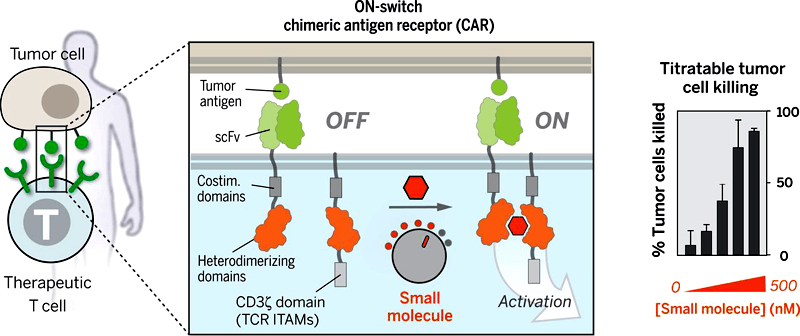
Рисунок 5. Титруемый контроль генноинженерных Т-клеток с помощью включаемого химерного антигенного рецептора. С обычным CAR Т-клетки активируются при соединении с клеткой-мишенью, при этом из-за очень сильного иммунного ответа есть риск высокой токсичности. «Включаемый» CAR требует небольшую стимулирующую молекулу для запуска терапевтической функции. Величину ответа (например, «убийства» клеток-мишеней) можно титровать, тем самым уменьшая токсичность при уменьшении количества небольшой стимулирующей молекулы. Рисунок из [11].
Внедрение «пульта управления» в Т-клетку с химерным антигенным рецептором — это пример простой и эффективной стратегии совмещения собственных и автономных решений клетки (например, обнаружение сигналов болезни) с контролируемыми пользователем из вне. Перегруппировка и расщепление основных частей CAR обеспечивает возможность «включения» и «выключения» химерных антигенных рецепторов. Данная работа также подчеркивает важность разработки оптимизированных биоинертных «пультов управления», таких как небольшие молекулы и свет, вместе с их клеточными компонентами реагирования, в целях повышения точности контролируемой терапии [11].
Таким образом, правильно дозируя препарат, можно управлять уровнем иммунной активности модифицированных Т-клеток. В частности, благодаря данной технологии можно снизить отрицательные последствия синдрома высвобождения цитокинов. Также иногда нормальные клетки экспрессируют небольшие количества белков, которые являются мишенью для Т-клеток с CAR. Поскольку модифицированные Т-клетки вводят в кровяное русло и они проходят через сердце и легкие, ткани этих органов могут быть повреждены прежде, чем Т-клетки достигнут своих намеченных целей в других частях тела. А с новой технологией Т-клетки будут в «выключенном» состоянии, пока не достигнут цели [10].
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
Активированные т лимфоциты. Активность cd4 т-клеток воспаления. Т-клетки взяли под контроль
Адаптивный иммунный ответ начинается с презентации антигена — встречи наивного Т-лимфоцита со своим уникальным антигеном. В результате клетка интенсивно делится — ведь в предстоящей борьбе из всех миллионов лимфоцитов будет участвовать только активированный клон (клоны), и её потомство дифференцируется в вооруженные эффекторные клетки. Однако презентации антигена недостаточно для активации Т-лимфоцита. Без дополнительной стимуляции презентация антигена приводит к апоптозу, анергии или развитию Т-регуляторных клеток. Такая реакция является защитой от аутоиммунного ответа: активация антигенного рецептора в отсутствие воспаления скорее всего означает, что клон аутореактивный. Однако такое возможно и при иммуносупрессии, например, вызванной опухолью. В таком случае иммунная толерантность играет против организма. Молекулярные механизмы тонкого контроля активации Т-лимфоцитов являются сегодня областью активного изучения.
Активация Т-клеточного рецептора
Т-клеточный рецептор (TCR), состоящий из двух цепей α и β, является тем самым рецептором, распознающим антиген и делающим каждый клон лимфоцитов уникальным. Однако сами по себе эти две цепи не активируют лимфоцит и даже не являются рецептором в строгом смысле слова, потому что не могут передавать сигнал внутрь клетки. Они являются частью рецепторного комплекса и только в сочетании с несколькими инвариантными компонентами обеспечивают сигнальную функцию. Инвариантные части рецептора: CD3 комплекс (CD3γ, CD3δ, CD3ε цепи) и ζ цепи — содержат ITAMs (immunoreceptor tyrosine-based activation motifs), фосфорилирование тирозиновых остатков в которых и инициирует весь сигнальный каскад после распознавания антигена. Наконец, еще одним необходимым компонентом являются ко-рецепторы – CD4 или CD8, которые распознают MHC II и MHC I соответственно. Они стабилизируют взаимодействие антигенного рецептора и комплекса «пептид–МНС», которое иначе может быть очень непрочным и недостаточно продолжительным для активации рецептора из-за низкой аффинности.
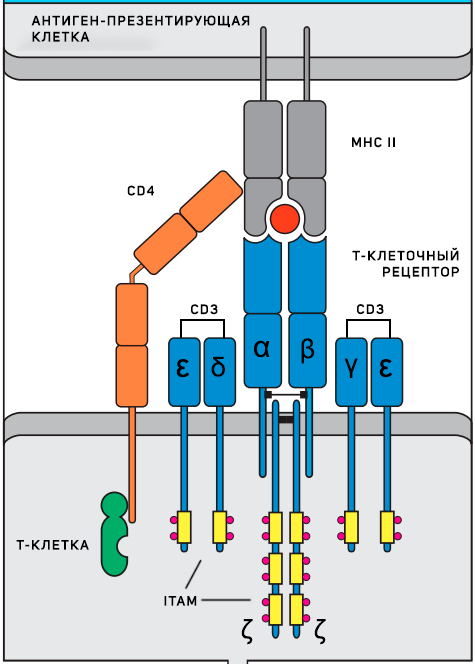
Схема Т-клеточного рецептора
Активацию Т-лимфоцита составляют несколько основных сигнальных путей:
- Активация фосфолипазы C-γ приводит к изменениям в транскрипции (экспрессия генов эффекторных клеток: гранзимы и цитокины и др.).
- Активация серин/треониновой киназы Akt активирует метаболизм (обеспечение процессов синтеза и пролиферации).
- Адапторный протеин ADAP усиливает адгезию (стабилизация контакта между Т-клеткой и антиген-презентирующей клеткой (АПК)). Клетки, лишённые ADAP активируются слабо, т.е. без без дополнительной адгезии контакт непрочный и недостаточный.
- Активация белка Vav приводит к изменениям в цитоскелете (формирование иммунного синапса — прочного контакта между Т-клеткой и АПК/В-клеткой/клеткой-мишенью).
Сигналинг от фосфолипазы С делится в свою очередь на три ветви:
- Выход кальция в цитоплазму активирует транскрипционный фактор NFAT (nuclear factor of activated T cells), который перемещается в ядро и активирует многие гены, необходимые для активации Т-лимфоцитов. NFAT настолько важен для иммунного ответа, что ингибиторы этого сигнального пути широко используются для предотвращения отторжения трансплантатов.
- Активация Ras запускает сигнальный путь MAPK и, в итоге, экспрессию транскрипционного фактора АР-1.
- Активация протеинкиназы C-θ (изоформа протеинкиназы С, встречающая только в Т-клетках и мышцах) активирует транскрипционные факторы NFκB.
- Антиапоптотический.
- Экспрессия рецепторов хоуминга и адгезии.
- Активация метаболизма, в т.ч. через активацию сигнального пути mTOR, который повышает скорость синтеза белков и липидов [1].
В активированной клетке повышается потребление железа, аминокислот и глюкозы и интенсивность гликолиза, что переводит ее в приоритетное положение для организма. Нарушение в процессах активации метаболизма приводят к дисфункции Т-лимфоцитов, например, при сепсисе. Это может быть частично компенсировано применением ИЛ-7 [2].
Ко-стимуляция
Сигналинг через TCR необходим, но недостаточен для активации Т-лимфоцита. Этот сигнал называют сигнал 1, а для активации необходимо сочетание сигнала 1 и сигнала 2. Рецепторы, в сочетании с TCR обеспечивающие активацию Т-лимфоцита, называют ко-стимулирующие рецепторы — сигнал 2. Антиген-презентирующие клетки несут на своей поверхности ко-стимулирующие лиганды. Для активации Т-клетка должна связаться с антигеном и ко-стимулирующим лигандом (сигнал 1 и сигнал 2) на одной и той же АПК. Эта мера необходима для того, чтобы активация происходила, только когда она действительно нужна. Отсутствие ко-стимуляции говорит об отсутствии воспаления, что скорее всего означает, что произошло узнавание собственного антигена, и иммунный ответ не запускается.
Главным рецептором Т-лимфоцитов является CD28, его несут все наивные Т-лимфоциты. Лигандами CD28 на АПК являются B7.1 (CD80) и B7.2 (CD86). Связывание CD28 с лигандами приводит к активации фосфолипазы С, Akt и Vav, т.е. усиливает большинство эффектов TCR сигналинга. Все они возможны только при сочетании двух сигналов. Рецепторы семейства TNF (OX40, 4-1BB, CD30, and CD27) — главные ко-стимулирующие рецепторы В-лимфоцитов – активируют Akt и NFκB. Кроме того, в качестве стимуляции может выступить непосредственное взаимодействие патогена с распознающими рецепторами такими, как TLR. Следует отметить, что концепция ко-стимуляции пересматривается и расширяется в настоящее время в связи с открытием новых ко-стимулирующих рецепторов, осуществляющих свои функции через разные механизмы. Показано, что ко-стимуляция, например через рецептор GITR, помимо помощи TCR сигналингу, участвует в определении судьбы Т-клетки [3]. Возможно, продолжающаяся стимуляция может вносить вклад в истощение Т-лимфоцитов [4].
Огромный интерес ко-стимулирующие рецепторы вызывают в области иммунотерапии рака, а именно адоптивной терапии, особенно после того, как было показано, что ко-стимуляции in vitro может быть достаточно, а значит можно избежать негативных эффектов системного применения [5]. Некоторые ко-стимулирующие рецепторы, такие как GITR, сейчас подтверждают свою эффективность в исследованиях с химерными антигенными рецепторами и могут быть в скором времени использованы в иммунотерапии в качестве дополнительного стимулирующего домена в составе химерного рецептора [6]. Кроме того, ингибиторы ко-стимулирующих рецепторов могут лечь в основу новых безопасных и эффективных методов терапии иммунных отторжений трасплантатов [7].
ICOS (inducible T-cell co-stimulator) — член семейства рецепторов CD28 — другой важный ко-стимулирующий рецептор. Сейчас он активно рассматривается в контексте лечения реакции “трансплантат-против-хозяина” [8]. А в иммунотерапии рака клинические испытания в настоящее время проходят и агонисты, и антагонисты этого рецептора [9]. Дело в том, что помимо усиления противоопухолевого Т-клеточного ответа, данный рецептор может активировать Т-регуляторные клетки и, следовательно, вносить вклад в иммуносупрессию. Ко-стимулирующий рецептор CD46 усиливает активацию CD8+ клеток и их развитие в цитотоксические Т-лимфоциты. Однако этот же рецептор угнетает продукцию IFN-γ Т-хелперами и индуцирует их развитие в регуляторные Т-клетки [10].
Ко-стимулирующие рецепторы критически важны для адекватного иммунного ответа. Так, недостаток ICOS вызывает иммунодефициты с широким спектром клинических проявлений, включая повышенную предрасположенность к инфекционным заболеваниям и злокачественным опухолям [11]. Баланс экспрессии ко-стимуляторных и ко-ингибиторных рецепторов на Т-лимфоцитах изменяется уже на ранних этапах развития опухолей, подчеркивая важность иммунного надзора и необходимость иммуносупрессии для формирования и прогрессии опухоли [12].
Ингибирование
Ингибиторные рецепторы контролируют развитие иммунного ответа и являются необходимым регулятором иммунного гомеостаза. Основные ингибиторные рецепторы относятся к тому же семейству, что и CD28, наиболее изученные включают CTLA-4 (CD152), PD-1 (programmed death-1), BTLA (B and T lymphocyte attenuator), TIGIT (T cell Ig and ITIM domain), TIM-3, LAG-3, CD96, среди последних открытых — PDPN, PROCR [13].
CTLA-4 хранится на внутриклеточных мембранах и перемещается на поверхность клетки, когда активируется антигенный рецептор. CTLA-4 связывает те же лиганды, что и CD28, но с более высокой аффинностью, и ингибируют тем самым сигнал 2. Другие ингибиторные рецепторы содержат ITIMs (immunoreceptor tyrosine-based inhibitory motif) и активируют внутриклеточные фосфатазы. Поскольку значительная часть сигналинга через TCR опосредована тирозинкиназами, фосфатазы ингибируют их эффекты. К таким рецепторам традиционно относят PD-1. Однако, недавние исследования показывают, что основной механизм действия — это дефосфорилирование CD-28 и, следовательно, нарушение ко-стимуляции [14]. Лиганды PD-1 экспрессируются самыми разнообразными клетками (PD-L1) или исключительно АПК (PD-L2). PD-1 экспрессируется на активированных Т-лимфоцитах и составляет важную петлю обратной связи, контролирующую экспансию лимфоцитов.
Ингибиторные рецепторы Т-лимфоцитов привлекают огромное внимание в контексте рака. Терапия, направленная на ингибирование данных рецепторов, носит название immune checkpoint blockade. Разнообразие ингибирующих рецепторов является одной из причин ее неэффективности. Так, было показано, что экспрессия Tim-3 может вызывать резистентность к блокаде PD-L1 [15]. Важную роль в ингибировании Т-лимфоцитов сегодня отводят интерлейкину 27. Именно он может стимулировать экспрессию ко-ингибиторных рецепторов и «помечать» таким образом Т-клетки для истощения. Стимуляции трех ко-ингибиторных рецепторов достаточно для того, чтобы Т-клетка стала дисфункциональной [13].
Антитела, блокирующие ингибиторные рецепторы и их лиганды, уже получили распространение в терапии опухолей (меланома, НМРЛ и др.). Однако сейчас огромный интерес вызывает перспектива сочетания традиционных видов терапии — радио- и химиотерапии с иммунотерапевтическими подходами. С одной стороны, уже понятно, что эффекты радио- и химиотерапии во многом опосредованы иммунными процессами. С другой стороны, гибель клеток в результате применения традиционных методов может сделать опухоль «горячей» — активно инфильтрированной иммунными клетками — и повысить эффективность иммунотерапии. Эффективность полимодальной терапии подверждается все новыми доклиническими исследованиями: иммунорадиотерапия + блокада PD-L1 [16].
Таким образом, активация Т-лимфоцитов требует тонкой регуляции, которая достигается балансом ко-стимулирующих и ингибиторных рецепторов. Недостаточная активация снижает эффективность иммунного ответа против инфекционных агентов и опухолевых клеток, чрезмерная активация приводит к аутоиммунным заболеваниям. Наши представления о процессах активации и ко-стимуляции Т-лимфоцитов до сих пор активно развиваются. Открытия в этой области проложат путь к новым возможностям терапии рака, аутоиммунных заболеваний и отторжения органов в трансплантологии.
Источники:
- Simon-Molas, Helga, et al. “PI3K–Akt signaling controls PFKFB3 expression during human T-lymphocyte activation.” Molecular and cellular biochemistry (2018): 1-11.
- Venet, Fabienne, et al. “IL-7 restores T lymphocyte immunometabolic failure in septic shock patients through mTOR activation.” The Journal of Immunology (2017): ji1700127.
- Cobbold, Stephen P., et al. “CD4+ T cell fate decisions are stochastic, precede cell division, depend on GITR co-stimulation, and are associated with uropodium development.” bioRxiv (2018): 298026.
- Ozkazanc, Didem, et al. “Functional exhaustion of CD4+ T cells induced by co‐stimulatory signals from myeloid leukaemia cells.” Immunology 149.4 (2016): 460-471.
- Pham Minh, Ngoc, et al. “In vivo antitumor function of tumor antigen‐specific CTLs generated in the presence of OX40 co‐stimulation in vitro.” International journal of cancer 142.11 (2018): 2335-2343.
- Golubovskaya, V. M., et al. “GITR domain inside CAR co-stimulates activity of CAR-T cells against cancer.” Frontiers in bioscience (Landmark edition) 23 (2018): 2245-2254.
- Herr, Florence, et al. “Co-stimulation blockade plus T-cell depletion in transplant patients: towards a steroid-and calcineurin inhibitor-free future?.” Drugs 76.17 (2016): 1589-1600.
- Zhang, Mengmeng, et al. “ICOS impacts chronic Graft-versus-Host Disease by regulating both pathogenic and regulatory T cells.” Frontiers in immunology 9 (2018): 1461.
- Amatore, Florent, Laurent Gorvel, and Daniel Olive. “Inducible Co-Stimulator (ICOS) as a potential therapeutic target for anti-cancer therapy.” Expert opinion on therapeutic targets 22.4 (2018): 343-351.
- Hansen, Aida S., et al. “CD46 is a potent co-stimulatory receptor for expansion of human IFN-γ-producing CD8+ T cells.” Immunology letters (2018).
- Schepp, Johanna, et al. “14 Years after Discovery: clinical Follow-up on 15 Patients with inducible co-stimulator Deficiency.” Frontiers in immunology 8 (2017): 964.
- Rutkowski, Jacek, et al. “Evaluation of peripheral blood T lymphocyte surface activation markers and transcription factors in patients with early stage non-small cell lung cancer.” Cellular immunology 322 (2017): 26-33.
- Chihara, Norio, et al. “Induction and transcriptional regulation of the co-inhibitory gene module in T cells.” Nature 558.7710 (2018): 454-459.
- O’donnell, Jake S., Mark J. Smyth, and Michele WL Teng. “PD1 functions by inhibiting CD28‐mediated co‐stimulation.” Clinical & translational immunology 6.5 (2017): e138.
- Avery, Lyndsay, et al. “Tim-3 co-stimulation promotes short-lived effector T cells, restricts memory precursors, and is dispensable for T cell exhaustion.” Proceedings of the National Academy of Sciences 115.10 (2018): 2455-2460.
- Zhuang, Yuan, et al. “PD-1 blockade enhances radio-immunotherapy efficacy in murine tumor models.” Journal of cancer research and clinical oncology (2018): 1-12.