Гематология: Развитие Т-лимфоцитов. Отбор (селекция) лимфоцитарного набора (репертуара); отбор лимфоцитов, не реагирующих на собственные (self) антены. Создание толерантности Двойные негативные т лимфоциты
Активация, дифференцировка и селекция лимфоцитов
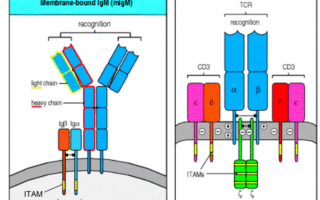
1) Сигнальные белки, входящие в комплексы BCR и TCR. ITAM и ITIM мотивы, SH2 домен.
2) Корецепторы BCR и TCR.
3) Основные рецепторы сигналов костимуляции на В и Т клетках.


FcR – рецепторы константных частей иммуноглобулинов
Про локализацию ITIM можно сказать, что есть у НК-клеток
SH2 – домен (Src-homologous) – структура, которая обеспечивает очень аффинное связывание с фосфорилированными тирозином, серином или треонином в составе ITАM и ITIM. Без фосфата нет взаимодействия!
4) Иммунологический синапс. устройство и биологическая роль
Иммунологический синапс – взаимодействие Т-клетки с антиген-презентирующей клеткой (АПК). При этом Т-лимфоцит плотно присасывается к клетке-мишени, в полость впрыскиваются цитокины – чтобы действовать локально. В синапсе также участвуют молекулы адгезии и костимуляции, рецепторы и корецепторы.
5) Роль киназы lck и фосфатазы CD45 в передаче сигнала от антигенных рецепторов лимфоцитов.
При инициации сигнала с TCR фосфатаза CD45 удаляет ингибирующий фосфат с киназы Lck. До этого в неактивном состоянии киназу Lck поддерживает киназа Csk. В неактивном состоянии киназа Lck свернута калачиком: ее SH2-домен связывается с ее же С-концевым фосфорилированным тирозином). После удаления ингибирующего фосфата киназа Lck изменяет конформацию, автоактивируется, фосфорилирует ITAM. ITAM с двумя фосфорилированными тирозинами – субстрат для Src-киназ с двумя SH2-доменами (например, киназа ZAP-70).
6) Основные физиологические последствия активации TCR.
Основные физиологические последствия активации TCR – фосфорилируются различные сигнальные молекулы (LAT и SLP-76), что приводит к:
● активации транскрипционных факторов (через PLCγ)
● повышению клеточной метаболической активности (через Act)
● полимеризации актина и реорганизации цитоскелета (через Vav)
● усилению адгезивных свойств поверхности: усилению “липкости” и кластеризации интегринов (через ADAP)
7) Внутриклеточный кальций и фосфолипиды в активации лимфоцитов. Семейства факторов транскрипции NFAT, NFkB и AP1.
Активация факторов транскрипции идет через PLCγ – фосфолипазу гамма. Она расщепляет PIP2 (фосфатидилинозитолдифосфат) на IP3 (инозитолтрифосфат) и DAG (диацилглицерол).
IP3 открывает кальциевые каналы в ЭПР и внешней мембране. DAG остается на мембране и привлекает PKC-θ и RasGRP (RAS guanyl-releasing protein), которые запускают МАР-киназный каскад, в котором активируются транскрипционные факторы 3 семейств (это самые важные):
● NFAT (через кальций и кальциневрин); одна из молекул этого семейства – мишень циклоспорина А – вещества, которое способно селективно подавлять Т-клеточный ответ (важно при пересадке органов)
● NFkB (через PKC-θ и CARMA)
● AP1 (через RasGRP, RAS и каскады МАР-киназ)
8) Роль фосфатидилинозитол-3-киназы (PI3K) в костимуляции. Механизм действия CTLA-4.
Молекула костимуляции (В7) появляется в ответ на реакцию врожденного иммунитета. Она узнается молекулой CD28. Через участки с тирозином происходит привлечение и активация фосфатидилинозитол-3-киназы (PI3K). Результатом ее работы является PIP3. PLCγ активируется, только когда привлекается к мембране и садится там на PIP3, заякоренный в мембране.
CTLA-4 – антагонист CD28. Он конкурирует с CD28 за связывание с В7 и всегда побеждает, так как более эффективно связывается за счет того, что делает это кластерами. То есть в присутствии CTLA-4 CD28 не связывается с В7. У CTLA-4 внутри ITIM – ингибирующие сигналы.
9) Роль ИЛ-2 и альфа-цепи рецептора ИЛ-2 в активации цитотоксических Т-клеток.
Для активации Т-киллера обязательно одновременное физическое взаимодействие с той же дендритной клеткой, с которой взаимодействует Т-хэлпер. При взаимодействии Т-хэлпера с ДК в ДК выделяется молекула костимуляции для Т-киллера (ее запоминать не надо, но вы не сможете забыть – она называется “четыре ай бибил” 4-IBBL).
Очень важна сильная положительная обратная связь через ИЛ-2 и CD25 (альфа-цепь высокоаффинного рецептора ИЛ-2 на поверхности Т-киллера). Сначала ИЛ-2 выделяет Т-хэлпер, а потом ИЛ-2 вызывает выработку ИЛ-2 в самом Т-киллере. Так клон Т-киллеров сам подгоняет себя в росте при пролиферации.
ИЛ-2 – пример интеграции сигнальных путей в промоторе его гена. У него в промоторе есть сайты связывания всех транскрипционных факторов из вопроса 3, то есть чтобы его транскрипция шла хорошо, необходим и сигнал от TCR, и сигнал костимуляции – от CD28.
10) Лиганды активирующих и ингибирующих рецепторов NK клеток.
Ингибирующие рецепторы связываются с набором молекул MHCI. Это важно, когда NK-клетка учится распознавать свое – ее будет активировать отсутствие этих лигандов = “отсутствие своего”.
Активирующие рецепторы связываются со стресс-индуцированными лигандами. NK-клетка активируется в ответ на повышение экспрессии стрессорных белков (“стресс-индуцированное свое”).
11) Логика развития лимфоцитов в первичных лимфоидных органах. Положительная и отрицательная селекция.
Пролиферация – экспрессия первой цепи Pre-B или Pre-T – снова пролиферация – экспрессия второй цепи (теперь есть полные антигенные рецепторы) – селекция (будущий лимфоцит элиминируется, если очень сильно связывается с антигеном либо не связывается вовсе).
Селекция в костном мозге: созревание В-клеток, экспрессирующих два иммуноглобулина – IgM и IgD + отбор клеток, реагирующих только на чужеродные антигены .
B-клетки, иммуноглобулиновые рецепторы которых способны взаимодействовать с собственными антигенами, либо погибают в результате апоптоза , либо приходят в состояние ареактивности (анергии).
Селекция в тимусе: Т-клетки экспрессируют или CD4 (будут хелперами), или CD8 (будут киллерами). Собственно селекция – по TCR-сигналу: если его нет или он сильный – клетка погибает. Если слабый – будет наивная Т-клетка, если умеренный – Т-регуляторная клетка.
12) Способы удаления из популяции зрелых лимфоцитов потенциально аутореактивных клонов. Редактирование антигенных рецепторов лимфоцитов.
Это было на примере В-лимфоцитов.
Если В-лимфоцит связался с растворенным аутоантигеном, то образуется анергичная В-клетка с с высоким уровнем экспрессии IgD (индукция анергии без костимуляции – механизм иммунологической толерантности).
Если В-лимфоцит связался со связанным с поверхностью аутоантигеном (на эритроцитах, МНС, то возможно редактирование рецептора в целях изменения специфичности (путем продолжения экспрессии RAG, перестройки генов легких цепей).
Если редактирование не получилось, апоптоз.
13) Первичный и вторичный иммунный ответ. Переключение с IgM на IgG, клетки памяти.
Первичный иммунный ответ – рецепторы лимфоцитов представлены IgM, низкая специфичность связывания с элементами патогенной архитектуры, IgM собран в пентамеры (первая встреча с патогеном, ответ развивается долго). Далее – выработка высокоспецифичного IgG (“подбором” – см. vdj-рекомбинацию), лимфоциты выбрасывают ген константной части IgM
Вторичный иммунный ответ – повторная встреча с патогеном, уже есть лимфоциты с нужным антигеном, ответ развивается очень быстро
Клетки памяти – лимфоциты, формирующие вторичный иммунный ответ
14) Особенности физиологии антигенных рецепторов B-1 и гамма-дельта-Т клеток, позволяющие отнести их к “врожденным лимфоцитам”.
популяция клеток В1 – они развиваются в печени новорожденных. Там они производят IgM (при активации – растворимые ИгМ). У них ограничен репертуар специфичности, используют только некоторые V-гены. Изначально настроены на часто встречающиеся гликаны на поверхности бактерий, на некоторые собственные антигены (регуляция, супрессорные цитокины), на собственные стрессорные антигены (экспрессируются в случае повреждений). В1-клетки не формируют иммунологической памяти. Каждый раз, как первый раз. ИгМ всегда в одном и том же количестве.
В1 клетки добавляют мало нуклеотидов на стыки сегментов, репертуар их V-генов ограниченный. Находятся в перитонеальной и плевральной полостях. В отличие от В2 клеток, которые живут и гибнут и обновляются в КМ, В1 клетки, заселившись на свои места локации, самообновляются на месте. Умеют производить самопроизвольно на высоком уровне IgM, часто имеют специфичность к углеводородам. Не формируют памяти.
Гамма-дельта T‐клетки могут взаимодействовать с MHCIb, но не с классическими молекулами MHC, и не требуют процессинга антигена для распознввания.
Для большинства гамма-дельта T- клеток лиганды точно не известны.
Гамма-дельта клеток довольно много там же, где В1 клетки. Они необходимы для распознавания небольших фосфолипидов. Есть в перитонеальной полости, их много в эпидермисе кожи, и некоторые из них (которые в частности специфичны к белкам бутирофилинового семейства) выполняют роль распознавания стресса. Бутирофилины на периферии экспрессируются в результате стресса. Пока лиганда нет, экспрессируются иммуносупрессорные цитокины. А при появлении достаточного количества лиганда, включается запуск иммунного ответа. Не формируют иммунологической памяти, относятся к клеткам врожденного иммунитета.
15) Позитивная селекция CD4+ и CD8+ Т-клеток в тимусе. MHC-рестрикция.
В кортикальной зоне тимуса происходит позитивная селекция Т-клеток – удаление клеток, у которых очень слабый сигнал от TCR.
Положительной селекции подвергаются дважды положительные тимоциты (CD4+CD8+) Дважды положительные клетки очень чувствительны к апоптозу (в связи с низкой экспрессией ими антиапоптотических факторов, таких, как Вс1-2 и Bcl-XL). Для выживания клеткам нужна поддержка микроокружения. Сигнал, необходимый для выживания, тимоциты получают в ходе положительной селекции. Положительная селекция обеспечивает отбор только тех тимоцитов, которые экспрессируют TCR, обладающие сродством к молекулам МНС. Если TCR обладает сродством к молекуле МНС, тимоцит получает поддерживающий сигнал, основными результатами которого служат повышение экспрессии антиапоптотического фактора Вс1-2 и продвижение тимоцита по клеточному циклу. Внешний признак успешного прохождения тимоцитом положительной селекции — экспрессия маркера активации клетки CD69, а также молекул CD5, CD27 и костимулирующей молекулы CD28, сопровождающаяся повышением плотности экспрессии рецепторного комплекса TCR—CD3на поверхности клетки. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию».
MHC-рестрикция – распознавание Т-лимфоцитами фрагментов антигенов только в контексте МНС (исключение – суперантигены).
МНС индивидуальны. Т-лимфоциты проходят позитивную селекцию на молекулах MHC, которые у каждого индивидуума свои, и пептидах, которые способны с этими аллелями связаться. У другого индивидуума набор молекул MHC будет другой, пептиды получатся тоже другие, в результате репертуар специфичностей зрелых лимфоцитов также будет отличаться.
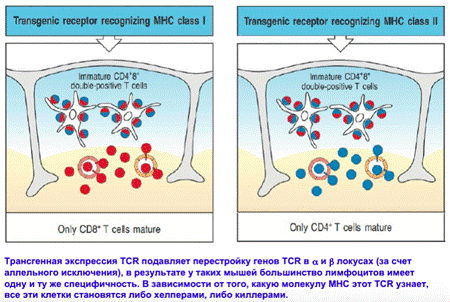
Развитие тимоцитов зависит от MHC. если мы подсадим мышке рецепторы на МНС1, то на выходе мы увидим только цитотоксические Т-клетки. У развивающихся тимоцитов в принципе не будет шанса экспрессировать рецептор на MHC2. То же будет, если подсадим мышу рецептор на MHC2.

16) Негативная селекция тимоцитов. Aire и Fas/FasL.
Каким образом развивающимся тимоцитам удается показать все собственные антигены, опасные с точки зрения аутореактивности (это и есть негативная селекция)?
Было непонятно, пока не открыли ген AIRE – это фактор транскрипции, под контролем которого находится около 100 специфичных белков, которые он запускает время от времени в некоторых клетках тимусного эпителия. Индуцирует экспрессию органо- или тканеспецифических генов в тимусе:
– insulin (пожелудочная железа)
– interphotoreceptor retinoid-binding protein (IRBP) (глаз)
– odorant binding protein 1a (слезные железы)
Если запустить небольшую часть на некоторое время – ничего страшного не произойдет, но в итоге все покажем, что надо. Чтобы поставить ген под контроль AIRE, или убрать, надо просто поменять пару нуклеотидов в промоторном участке гена (легкая регуляция).
Это один из механизмов центральной толерантности. Очень легко настраиваемый – нужно всего лишь поменять несколько нуклеотидов в промоторе для регуляции.
Нарушения функции AIRE вызывают аутоиммунный полигландулярный синдром 1-го типа, или хронический кожно-слизистый кандидиоз (autoimmune polyendocrinopathy-candidiasis- ectodermal dystrophy, APECED) – редкое наследственное заболевание, характеризующееся аутоиммунным ответом на ткани разных органов, преимущественно эдокринных желез.
AIRE-зависимая экспрессия тканеспецифических антигенов в клетках тимусного эпителия – один из механизмов центральной толерантности.
Если тимоцит аутореактивный, то он точно рано или поздно во время созревания встретиться со своим пептидом, и будет уничтожен отбором.
FasL и Fas обеспечивают апоптоз (если не удалось перестроить рецептор лимфоцита). Это цитокин и его рецептор, обеспечивающие структурный (инструктивный?) апоптоз. Мыши-нокауты по этим генам – гипертолерантность лимфоцитов, аутоиммунное действие.
17) Роль цитокинов в дифференцировке Т-хелперов на периферии.
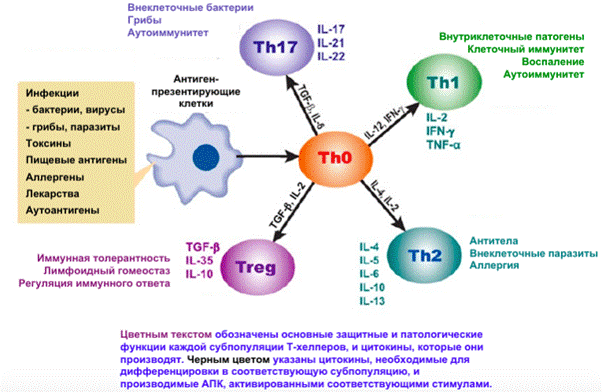
18) Негативные последствия несбалансированной дифференцировки Т-хелперов.
Гематология: Развитие Т-лимфоцитов. Отбор (селекция) лимфоцитарного набора (репертуара); отбор лимфоцитов, не реагирующих на собственные (self) антены. Создание толерантности Двойные негативные т лимфоциты
Предшественники, прекоммитированные к развитию в Т-лимфоциты, непрерывно мигрируют от костного мозга в вилочковую железу, однако их число, по-видимому, очень мало. Незрелые предшественники Т-клеток поступают в область коры вилочковой железы, где созревают в функциональные субпопуляции Т-клеток. Особенностью развития тимоцитов является высокая скорость пролиферации.
У человека возможно и экстратимическое созревание Т-клеток, однако для оптимального развития Т-лимфоцитов необходимо наличие неповрежденной вилочковой железы.
Различные стадии развития тимоцита можно определить по изменению экспрессии поверхностных и цитоплазматических молекул, рецепторов цитокинов и состояния реаранжировки генов Т-клеточного рецептора. Т-клеточный рецептор (TCR) распознает только короткие пептиды, которые заполняют полость в молекулах первого или второго класса главного комплекса гистосовместимости (МНС I и II, МНС комплекс у человека обозначается как HLA). Презентация таких пептидов Т-лимфоцитам обеспечивается антигенпредставляющими клетками.
TCR — гетеродимерный комплекс, сформированный при ассоциации а-и бета- или у- и S-субъединиц. Каждая из этих субъединиц кодируется отдельным геном. Т-клетки с рецепторами типов ар и уq являются различными линиями, которые разделяются до начала реаранжировки гена TCR.
Наименее зрелые клетки-предшественники в вилочковой железе экспрессируют антиген CD7. Некоторые из них экспрессируют также CD44. CD44, рецептор для гиалуроновой кислоты, — один из факторов, определяющих перемещение предшественников Т-клеток в вилочковую железу. Из этих предшественников далее образуются CD2+/CD7+ клетки, в цитоплазме которых присутствует CD3. Белковый комплекс CD3 обеспечивает передачу сигналов через TCR.
Пептидные цепи CD3-комплекса начинают синтезироваться на стадии про-Т-лимфоцита, и их экспрессия предшествует появлению на мембране TCR.
Т-лимфоциты уq-линии первыми начинают экспрессировать рецептор CD3, но на них нет молекул CD4 или CD8. Несколько позднее на поверхности клеток, экспрессирующих рецептор типа аb, начинают одновременно экспрессироваться антигены CD4 и CD8. К этому времени заканчивается реаранжировка генов а- и р-цепей, и на поверхности клеток экспрессируется рецепторный комплекс TCR ab/CD3.
По мере того как клетки, экспрессирующие CD4+, CD8+ и TCR (так называемые дважды положительные клетки), проходят от коры к мозговому веществу вилочковой железы, они созревают в CD4+ хелперные или CD8+ цитотоксические Т-клетки. Клетки, которые созревают до стадии CD4+ или CD8+, составляют менее 5% тимоцитов. Эти лимфоциты покидают вилочковую железу и заполняют вторичные лимфоидные ткани (лимфатические узлы, селезенку, лимфоидную ткань, ассоциированную со слизистыми оболочками).
Т-лимфоциты с рецептором уq и CD5+B1-клетки являются функционально аналогичными популяциями, которые развиваются параллельно. Т-клетки с рецептором типа уq найдены в различных тканях, включая селезенку, эпидермис и эпителий слизистой оболочки матки, влагалища и языка. Предполагается, что эта популяция клеток может исполнять роль иммунного надзора в перечисленных тканях.
Формирование комплекса Т-клеточного рецептора и положительная и отрицательная селекция в вилочковой железе
Как и гены иммуноглобулинов, гены Т-клеточного рецептора собираются из различных сегментов, находящихся первоначально в зародышевой конфигурации. Гены Т-клеточного рецептора подвергаются процессу соматической реаранжировки, при которой кодирующие сегменты присоединяются друг к другу, а присутствующие между ними интронные последовательности удаляются. Вариабельность соединений и вставок обеспечивает возникновение различий TCR и приводит к огромному количеству различных последовательностей гипервариабельного участка TCR. Репертуар различных TCR считается даже большим, чем репертуар молекул Ig (по оценкам, репертуар ab-TCR составляет 1015, а для yq-TCR — 1018). В отличие от В-лимфоцитов, Т-лимфоциты не секретируют свои рецепторы.
Дважды позитивный тимоцит проходит через многоступенчатый процесс, известный как тимическая селекция. На первой фазе, называемой положительной селекцией, TCR дважды позитивного тимоцита взаимодействуют с молекулами МНС, которые экспрессируются эпителиальными клетками в коре вилочковой железы. Тимоциты, способные распознавать комплекс антигена с молекулой HLA, ускользают от апоптоза и вступают в дальнейшую дифференцировку, в то время как тимоциты, не способные к такому взаимодействию, погибают.
Поскольку рекомбинации, затрагивающие возникновение TCR, являются случайными, в вилочковой железе могут развиваться и пройти позитивную селекцию Т-клетки, экспрессирующие TCR, специфичные к чужеродным и собственным антигенам. Существует вероятность, что Т-клетки, реактивные к собственным структурам организма, будут взаимодействовать с аутоантигенами в тканях, что может привести к нежелательным аутоиммунным реакциям. Для предотвращения этого дважды положительные клетки подвергаются второй фазе отбора, которая называется негативной селекцией. В ходе этой фазы дважды положительные клетки взаимодействуют с комплексом МНС-пептид, экспрессированным на поверхности дендритной клетки.
Т-клетки, TCR которых взаимодействует с комплексом МНС-пептид с высокой аффинностью, подвергаются апоптозу. В ходе негативной селекции удаляются Т-клетки, экспрессирующие TCR, обладающие реактивностью к собственным антигенам.
Дважды положительные клетки, пережившие негативную селекцию, снижают экспрессию корецепторов CD4 или CD8, что приводит к развитию или CD4+CD8″ или CD4″CD8+ (моноположительных) Т-лимфоцитов. При этом Т-лимфоциты, распознающие антигены, представляемые молекулами МНС II класса, сохраняют экспрессию корецептора CD4+, a Т-лимфоциты, распознающие антигены, представляемые молекулами МНС I класса, сохраняют экспрессию корецептора CD8+. Эти клетки покидают вилочковую железу и образуют периферические зрелые CD4+ и CD8+ Т-клетки.
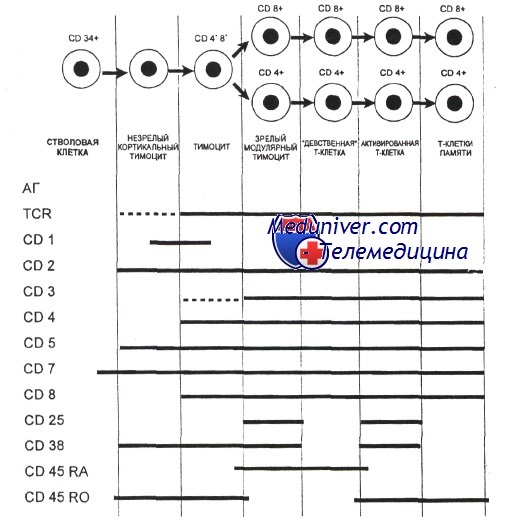 Экспрессия некоторых поверхностных молекул при развитии Т-клеток
Экспрессия некоторых поверхностных молекул при развитии Т-клеток
Клетки и цитокины, регулирующие развитие Т-клеток
Вилочковая железа состоит из корковой и медуллярной областей, различающихся по количеству тимоцитов и составу стромальных клеток. Стромальные клетки вилочковой железы влияют на развитие тимоцитов как посредством прямых межклеточных взаимодействий, так и секрецией растворимых медиаторов.
Тимоциты и клетки тимического эпителия экспрессируют ряд поверхностных клеточных детерминант, некоторые из которых вовлечены в адгезию этих клеточных популяций друг к другу. Рецептор CD2 на тимоцитах определяет связывание с детерминантой CD58 (LFA-3) и межклеточной адгезионной молекулой-1 (ICAM-1), представленными на клетках тимического эпителия. Взаимодействия между развивающимися лимфоцитами и стромой могут активировать обе популяции. Например, связывание тимоцитов со стромой может стимулировать продукцию ИЛ-1 стромальными клетками и повышать экспрессию рецептора ИЛ-2 на тимоцитах.
ИЛ-7 стимулирует полиферацию тимоцитов, и фактор стволовых клеток увеличивает этот эффект. Эпителиальные клетки вилочковой железы у человека являются источником цитокинов ИЛ- 1а и b, ИЛ-3, ИЛ-6, ИЛ-8, колониестимулирующих факторов (Г-КСФ и ГМ-КСФ), лейкозингибирующего фактора (LIF) и TGF-p, а также гормонов тимозина или тимопоэтина, оказывающих влияние на пролиферацию и дифференцировку тимоцитов.
Цитокины, необходимые для развития Т-клеток, могут продуцироваться самими Т-клетками. Тимоциты производят IFN-y, ФНО-а, ИЛ-2, ИЛ-3 и ИЛ-4.
Естественные киллерные клетки. Естественные киллеры (NK) обладают способностью спонтанно лизировать некоторые опухолевые клетки-мишени. Человеческие NK-клетки экспрессируют CD16 и CD56, но не имеют TCR или CD3. По морфологическим характеристикам эти клетки представляют собой большие гранулярные лимфоциты (в них присутствуют крупные цитоплазматические гранулы). NK-клетки имеют гемопоэтическое происхождение и развиваются в костном мозге, но пока мало известно об их предшественниках.
Гематология: Развитие Т-лимфоцитов. Отбор (селекция) лимфоцитарного набора (репертуара); отбор лимфоцитов, не реагирующих на собственные (self) антены. Создание толерантности Двойные негативные т лимфоциты
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 10 7 –10 9 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.
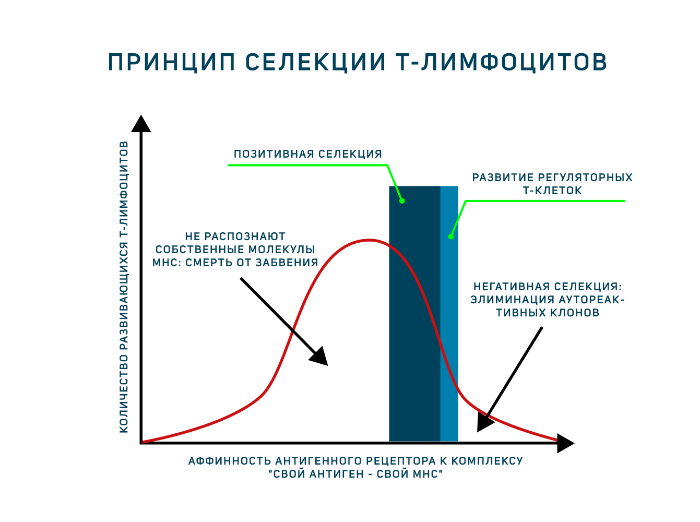
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
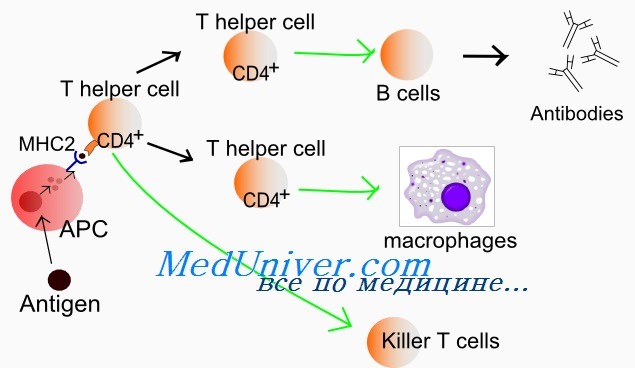
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Уютный сайт о здоровье
Описанный выше этап дифференцировки клеток характеризуется тем, что в организме появляется большое количество Т- и В-лимфоцитов, которые с помощью своих антигенраспознающих рецепторов (ТАГРР и ВАГРР) обладают способностью распознавать как собственные (self, ауто), так и чужие (non-self, алло) антигены. Это потенциально опасно, поскольку ауто-реактивные Т- и В-лимфоциты при определенных обстоятельствах могут стать причиной срыва толерантности и развития аутоиммунных заболеваний. Поэтому очередной этап развития иммунной системы со¬стоит в том, чтобы среди большого пула Т- и В-лимфоцитов отобрать (селекционировать) такие, которые бы не реагировали с собственными антигенами, но при этом сохраняли способность различать чужеродные антигены. Итак, третий этап антигеннезависимой дифференцировки лимфоидных клеток – развитие (индукция) толерантности (ареактивности, терпимости) по отношению к аутоантигенам.
Первичная функция ТАГРР на тимоцитах и ВАГРР на предшественниках В-лимфоцитов заключается в том, что с их помощью передается сигнал, который приводит к отбору (селекции) лимфоидных клеток, реагирующих на ауто-АГ.
Вторичная функция ТАГРР и ВАГРР – участие в иммунном ответе на этапе распознавания чужеродных антигенов.
Различают три пути отбора (селекции) лимфоидных клеток.
1. Разрушение (делеция) аутореактивных Т- и В-лимфоцитов, обладающих высокой авидно-стью (сродством) к ауто-АГ, – негативная селекция; происходит в центральных органах им¬мунитета.
2. Индукция (установление) анергии аутореактивных лимфоидных клеток. Этот путь селекции реализуется на периферии, лимфоциты при этом не погибают вследствие их невысокой авидности по отношению к ауто-АГ. Такая форма негативной селекции резервирует Т- и В-клетки в состоянии иммунологической толерантности (неотвечаемости), но при этом очень часто они сохраняют на своей поверхности аутореагирующие рецепторы.
Поскольку эмбриональный период является периодом формирования толерантности иммунной системы, то можно достичь толерантности к чужеродным антигенам, если в этот период искусственно ввести их в организм.
3.Позитивная селекция; состоит в том, что в тимусе и костном мозге контакт незрелых лимфоцитов и пре-В-лимфоцитов с ауто-АГ индуцирует созревание Т- и В-лимфоцитов, но поскольку сигнал клеток получается недостаточным из-за низкой авидности, то пролиферация клеток не наступает, а значит не происходит и развитие иммунного ответа.
Рассматривается также еще один – четвертый механизм толерантности за счет формирования на периферии активной супрессии в результате функции Т-регуляторных клеток либо дис-баланса Т-хелперов 1-го и 2-го типов, о чем речь будет идти ниже.
Как уже упоминалось, сохранившиеся в организме аутореактивные Т- и В-лимфоциты при определенных обстоятельствах могут стать причиной срыва толерантности и развития аутоиммунного заболевания.
На этапе индукции толерантности в вилочковой железе из тимоцитов, которые несут два дифференцировочных антигена CD4 и CD8 и являются так называемыми CD4+CD8+ клетками, образуются субпопуляции Т-лимфоцитов: Т-хелперы (CD4+CD8- клетки) и Т-киллеры/супрессоры (CD4-CD8+ клетки).
На этом заканчивается период антигеннезависимой дифференцировки Т- и В-лимфоцитов, они покидают вилочковую железу и костный мозг и расселяются в Т- и В-зонах (соответственно) периферических органов иммунной системы. Расселяющиеся лимфоциты называются зрелыми покоящимися клетками, готовыми к иммунному ответу. Все они находятся в G(0) фазе клеточ-ного цикла.
Следует помнить, что Т- и В-клетки на своей поверхности экспрессируют антигенраспознающие рецепторы, которые способны распознать только один антиген (точнее, одну детерминанту (эпитоп)).
Таким образом, специальными органами, где происходит дифференцировка гемопоэтиче-ских стволовых клеток, служат: для Т-лимфоцитов – тимус, для В-лимфоцитов – в эмбриональном периоде – печень, во взрослом организме – костный мозг.
Различают следующие основные этапы развития и дифференцировки Т- и В-лимфоцитов.
Первый этап – продуцирование большого числа Т- и В-лимфоцитов, обладающих специфичностью к различным антигенам (в том числе и к антигенам собственного организма). Этот этап имеет две важные стадии:
1. Стадию раннего предшественника, когда на поверхности будущего В-лимфоцита появляется суррогатная L-цепь иммуноглобулина. а на поверхности будущего Т-лимфоцита— ГП-33 (один из элементов ТАГРР);
2. Стадию незрелого предшественника, когда на В-лимфоцитах появляется молекула иммуноглобулина или ВГРАР, а на поверхности Т-лимфоцита – ТАГРР с альфа-, бета- или гамма-, дельта-цепями.
Второй этап – элиминация из громадного количества зрелых предшественников тех клеток, которые являются реактивными по отношению к собственным антигенам. В результате такого “обучения” иммунной системы развивается состояние толерантности.
Третий этап – дозревание оставшихся лимфоидных клеток и превращение их в зрелые покоящиеся Т- и В-лимфоциты, способные реагировать на чужеродные антигены.
Далее более подробно рассматриваются морфологические и функциональные свойства двух основных популяций лимфоцитов, реализующих приобретенный (специфический) иммунитет.