Результаты эндохирургического лечения ахалазии кардии. Способ хирургического лечения ахалазии пищевода Операция геллера с какого года проводится
Результаты эндохирургического лечения ахалазии кардии. Способ хирургического лечения ахалазии пищевода Операция геллера с какого года проводится
а) Показания к лапароскопической эзофагомиотомии по Геллеру с пластикой по Toupet. Показания к лапароскопической эзофагомиото-мии по Геллеру с фундопликацией (на 270°) по Toupet не отличаются от приведённых в предыдущей главе применительно к эзофагомиотомии с пластикой по Belsey. В настоящее время фундопликацию по Toupet применяют для создания нового нижнего сфинктера пищевода чаще, чем операцию Belsey Mark IV.
б) Техника лапароскопической эзофагомиотомии по Геллеру с пластикой по Toupet. Больного укладывают на спину. Места расположения портов идентичны применяемым при лапароскопической фундопликации по Ниссену. Брюшную полость раздувают газом через небольшой разрез, а также иглу Veress, введённую чуть ниже пупка.
Во время инсуффляции газа больного помещают в обратное положение Тренделенбурга. Только после полного раздувания живота намечают места для установки портов. Измерения проводят от мечевидного отростка (либо, что точнее, места схождения рёберных дуг около мечевидного отростка). Находят точку, расположенную на расстоянии 16 см ниже мечевидного отростка и на 3-4 см слева от средней линии.
Она обеспечивает наилучший обзор угла Гиса и пространства позади пищеводно-желудочного соединения в левой половине тела больного. Проведение дополнительных портов контролируют визуально, через лапароскоп.
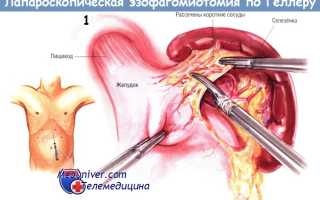
Сначала проводят ревизию живота для исключения иной патологии. Затем латеральный сегмент левой доли печени отводят фиксируемым лапароскопическим ретрактором, чтобы создать экспозицию передней верхней поверхности желудка.
Как и при фундопликации по Ниссену, пересекают короткие сосуды желудка диатермокоагулятором при достаточно высокой мощности. Пересечение начинают со средней трети большой кривизны желудка и продолжают по направлению к верхнему полюсу селезёнки, обнажая угол Гиса и левую ножку диафрагмы. В результате открывается пространство позади пищевода слева от него.
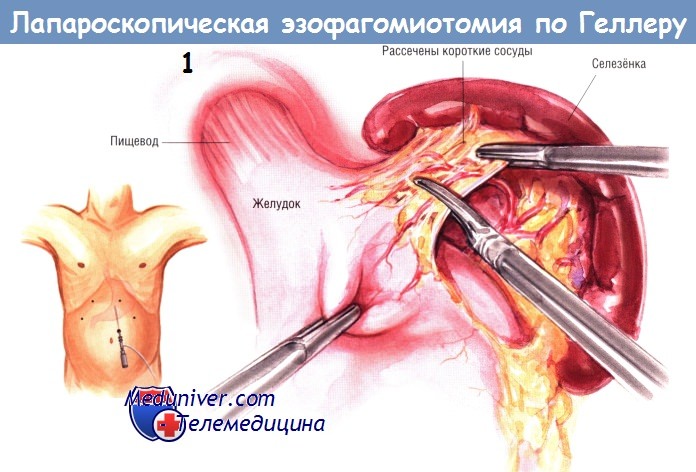
Правая сторона пищевода и позадипищеводное пространство препарируют так же, как при лапароскопической фундопликации Ниссена, и проводят малый дренаж Пенроуза вокруг пищеводно-желудочного перехода для оттягивания и создания экспозиции. Пространство между передней поверхностью пищевода и аркой ножек диафрагмы тщательно препарируют и раскрывают, создавая полость, продолжающуюся в краниальном направлении в переднее средостение.
Во время этой диссекции идентифицируют и защищают передний блуждающий нерв. При этом препарировании мобилизуют пищевод, удлиняют его интраабдоминальный отдел и создают экспозицию его передней стенки для миотомии.
Миотомию можно выполнить «холодными» ножницами, ножницами-коагулятором, крючком-коагулятором или иным специальным инструментом. Крючок-коагулятор позволяет проводить тонкую диссекцию и приподнимание отдельных волокон. Крючок используют для разделения волокон и приподнимания их от глубжележащих тканей во время подключения электрической энергии. Такое приподнимание предотвращает ранение пищевода.
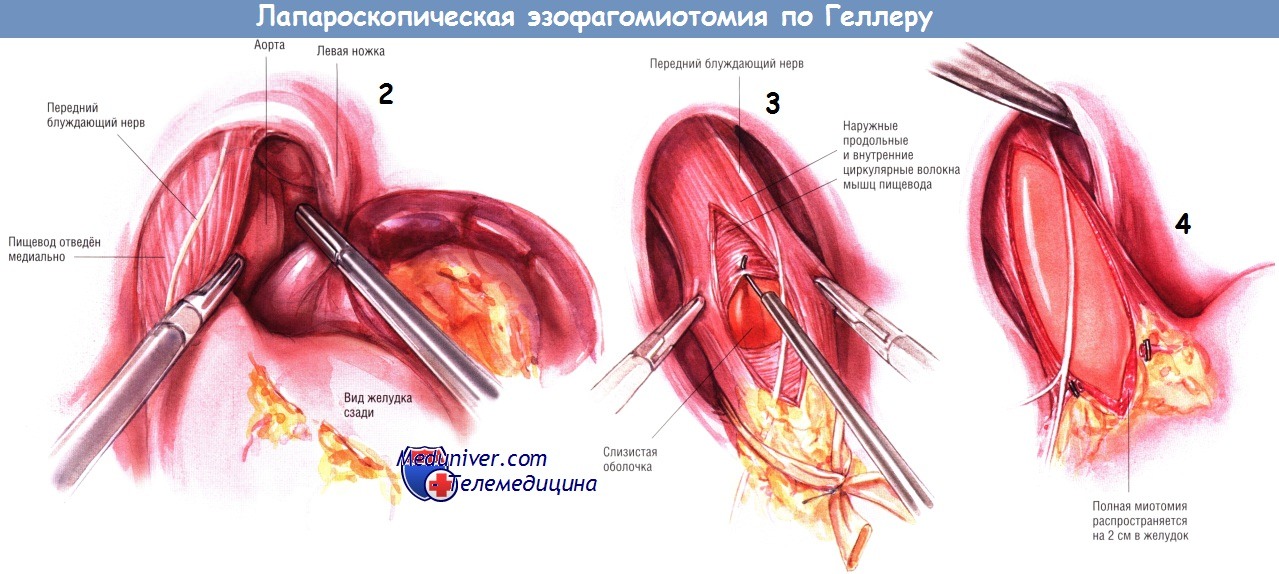
Сложность этой диссекции в том, что при ней необходимо отделить наружные продольные волокна и рассечь внутренние циркулярные волокна, не повреждая слизистой оболочки. Когда хирург войдёт в нужный слой, диссекция становится лёгкой, поскольку пространство между слизистой оболочкой и мышцами легко разделяется. После отделения от мышц слизистая оболочка начинает выбухать наружу. Диссекцию продолжают вниз на желудок на достаточное расстояние (на 2 см ниже перекрещивающих вен, служащих ориентиром места перехода пищевода в желудок). Общая длина миотомии должна быть не менее 7 см.
Так же, как и при фундопликации по Ниссену, ножки диафрагмы сопоставляют, сшивая их сзади от пищеводно-желудочного соединения, используя тефлоновые прокладки, — как это было описано в разделе «Лапароскопическая фундопликация по Ниссену».
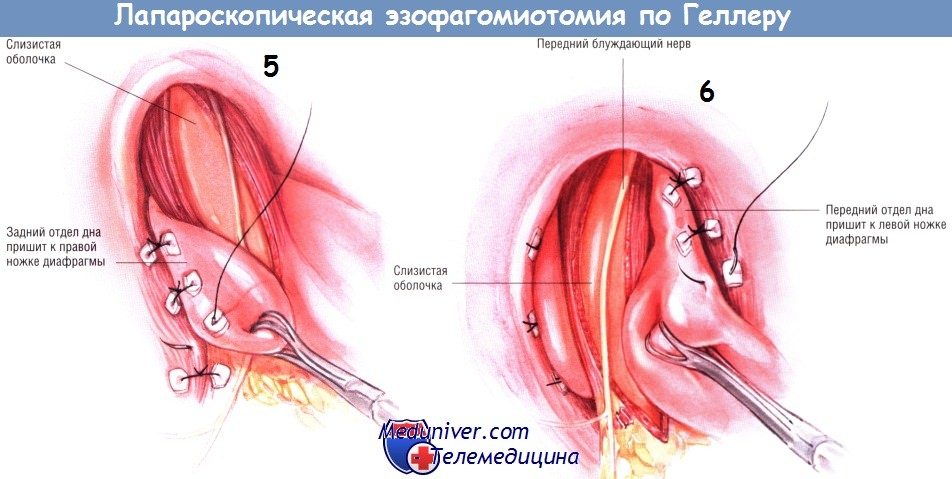
Позднее оборачивают пищевод сзади на 270°, натягивая заднюю часть дна желудка позади пищевода атравматическим зажимом. Затем дно желудка через прокладки подшивают лапароскопически к правой ножке диафрагмы. Аналогично переднюю часть дна желудка подшивают через прокладки к левой ножке диафрагмы.
Когда швы будут наложены, каждую сторону дна желудка подшивают за края пересечённого мышечного слоя пищевода. Вместе эти швы фиксируют 270° манжету и удерживают края мышц, разделённых при миотомии, в разведённом состоянии.
Проводят лапароскопическую ревизию брюшной полости для исключения кровотечения или случайных травм. Затем выполняют эзофагоскопию, чтобы оценить область реконструкции изнутри пищевода. Если миотомия адекватна, эндоскоп легко пройдёт из пищевода в желудок. Чтобы убедиться в отсутствии дефекта слизистой оболочки, на переднюю стенку пищевода наливают жидкость и одновременно инсуффлируют воздух через эзофагоскоп. После этого лапароскоп удаляют и закрывают места установки портов.
Результаты эндохирургического лечения ахалазии кардии. Способ хирургического лечения ахалазии пищевода Операция геллера с какого года проводится
Проведен анализ результатов эндохирургического лечения 141 пациента ахалазией кардии. Всем больным была выполнена лапароскопическая эзофагокардиомиотомия по Геллеру – Дору. Для интраоперационного контроля целостности слизистой оболочки пищевода использовался трансиллюминационный зонд. Положительные результаты малоинвазивного лечения достигнуты у 82,3% больных. Среди осложнений превалировала интраоперационная перфорация слизистой оболочки пищевода. Послеоперационный рецидив дисфагии диагностирован у 12% больных. Лечение данной категории пациентов потребовало строго индивидуализированной тактики.
Results of endosurgical treatment at achalasia cardia
The analysis of results of endosurgical treatment of 141 patients with achalasia cardia is carried out. All patients executed a laparoscopic esophagocardiomiotomy according by Geller – Dor. For intraoperative control of integrity of a mucous membrane of esophagus the transillumination probe was used. Positive results of low-invasive treatment are reached at 82,3% of patients. Among complications intraoperative perforation of mucous membrane of esophagus prevailed. Postoperative recurrence of a dysphagy is diagnosed for 12% of patients. Treatment of this category of patients demanded strictly individualized tactics.
Среди заболеваний различных органов и систем одно из первых мест принадлежит патологии желудочно-кишечного тракта. Немалая часть из них приходится на долю доброкачественной патологии пищевода. Это относится к таким заболеваниям, как ахалазия кардии (АК), грыжи пищеводного отверстия диафрагмы, подслизистые доброкачественные опухоли и дивертикулы пищевода. Нередки случаи, когда доброкачественная патология пищевода вовремя не диагностируется. Данное обстоятельство объясняется недостаточным знакомством большинства врачей разных специальностей с вопросами диагностики и лечения доброкачественной патологии пищевода [1].
Несмотря на доброкачественный характер вышеперечисленных заболеваний пищевода, при их несвоевременном лечении развиваются тяжелые осложнения, которые могут привести к гибели больного. Так, N. Barrett (1964) на основании своих наблюдений считал АК «фатальной болезнью», поскольку она явилась причиной преждевременной смерти многих его пациентов от перфорации пищевода, медиастинита, рака пищевода и кахексии [2].
Наиболее раннее упоминание об АК в литературе относилось к 1672 году и принадлежало английскому врачу T.Willis, который описал больного, страдавшего дисфагией и регургитацией. В 1679 году в Лондоне вышла его книга «Pharmaceutice rationales sive diatribe de medicamentorum operationibus in humono corpora», в которой было описано заболевание пищевода, возникшее без видимых причин, сопровождающееся задержкой пищи, срыгиванием и расширением органа.
Первое в истории анатомическое описание заболевания с расширенным пищеводом, но без опухоли или ожога, принадлежало P. Purton в 1821 году, который изучил трупы трех больных, умерших от истощения вследствие дисфагии. Впоследствии J. Mikulicz в 1882 году назвал данную патологию кардиоспазмом. Сам термин «ахалазия» предложил С. Perry, а ввел в практику A. Hurst в 1914 году. Данный термин наиболее точно отражает клиническую сущность заболевания: по-гречески «а» — отрицание, «халазис» — расслабление.
АК — заболевание, характеризующееся нарушением рефлекторного раскрытия кардии при глотании, нарушением перистальтики и прогрессирующим снижением тонуса тубулярного отдела пищевода [3]. АК наиболее часто встречается в трудоспособном возрасте — 20-50 лет [4, 5], нередко приводит к тяжелой алиментарной дистрофии, иногда к инвалидности пациента. АК является предраковым заболеванием: риск возникновения рака пищевода на ее фоне увеличивается в 14,5-33 раза [6-8], частота злокачественной трансформации заболевания составляет 88 человек на 100 000 пациентов с АК, что указывает на необходимость более раннего выявления и лечения этой группы больных [9].
В настоящее время в лечении АК широко применяются различные малоинвазивные методы: лапароскопическая кардиомиотомия по Геллеру – Дору, различные варианты кардиодилатации, эндоскопическое интрасфинктерное введение ботулинического токсина А [3-5].
На сегодняшний день наиболее оптимальным способом лечения АК, признанным во всем мире, следует считать, разработанную E. Heller в 1913 году переднюю вертикальную внеслизистую эзофагокардиомиотомию, так как данная операция обеспечивает адекватный пассаж пищи в желудок из пищевода [10, 11]. Но небольшому по объему и простому в техническом отношении внутриполостному этапу операции предшествовало травматичное чревосечение (лапаротомия или торакотомия). Исходя из данного обстоятельства, показания к операции Геллера были минимизированы.
И все же следует признать, что наиболее эффективным методом лечения АК оставалось оперативное пособие, при котором хорошие и отличные результаты достигали 95% в ближайшем послеоперационном периоде, а также на сроках более 5 лет [12]. Внедрение эндохирургических технологий оказало, несомненно, революционное влияние на хирургическое лечение АК. Многочисленные исследования продемонстрировали высокую эффективность лапароскопической операции Геллера – Дора, результативность которой была сопоставимой с эзофагокардиомиотомией, выполняемой из лапаротомного доступа [13, 14]. При этом пациенты уже на 2–3-и сутки могли быть выписаны из стационара. Эффективность лапароскопической эзофагокардиомиотомии по Геллеру – Дору несомненна: отличные результаты были достигнуты у 80-95% больных [11, 15].
Однако, несмотря на малую травматичность доступа, хороший косметический эффект, раннюю реабилитацию больного, имеются специфические осложнения в ходе лапароскопической эзофагокардиомиотомии в виде интраоперационной перфорации слизистой пищевода, которая встречается по данным литературы, в 8-25% случаев [16, 17]. Как в раннем послеоперационном периоде, так и на отдаленных сроках после эндохирургического вмешательства рецидивы дисфагии развиваются у 5-14% больных [18, 19].
Материалы и методы
В период с 1998 по 2011 год на базе отделения хирургии пищевода (онкологическое отделение № 2) Республиканского клинического онкологического диспансера Министерства здравоохранения Республики Татарстан 141 больному АК выполнили лапароскопическую операцию Геллера – Дора. Мужчин было — 66 , женщин — 75. Возраст больных составил от 18 до 78 лет (в среднем 48 лет). Распределение больных, в зависимости от показаний к выполнению лапароскопической операции Геллера – Дора представлены в таблице 1.
Показания к лапароскопической операции Геллера – Дора
Непосредственные результаты оперативного лечения ахалазии пищевода
Среди 170 наблюдавшихся нами больных оперативное лечение выполнено у 75 чел. (44,1+3,8%). Преобладали пациенты с III и IV стадией АП (по 32 чел. 42,7+5,7%), со II стадией было 11 больных (14,6+0,2%). Пациентам с I стадией АП оперативное лечение не применялось.
Использованы различные оперативные доступы (Табл. 15). Большинство больных оперировано видеолапароскопически -50 чел (66,7+5,4%). До внедрения в практику нашей клиники видеоэндоскопических технологий операции выполнялись из традиционных доступов – у 4 пациентов (5,3+0,3%) использована торакотомия, у 21 (28,0+5,2%) – лапаротомия. С 1997 г. все больные с АП нами оперированы видеолапароскопически. Независимо от доступа выполнялась эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор для закрытия мышечного дефекта в стенке пищевода и создания антирефлюксного механизма.
Модифицированная нами видеолапароскопическая эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор выполнялась следующим образом. Анестезия – общая, комбинированная, с искусственной вентиляцией легких.
Положение больного на операционном столе при введении в наркоз и установки лапаропортов – горизонтальное, на спине. После визуализации брюшной полости больного переводили в положение с поднятым головным концом операционного стола на 20-25 градусов инаклономнаправыйбок на 25-30 градусов. Это положение позволяет сместить внутренние органы и увеличить объем пространства в области оперативного вмешательства. Операционная бригада состоит из 4 человек. Справа от больного находится оперирующий хирург и операционная сестра, слева -2 ассистента.
Справа и слева от головной части операционного столанаходятся двавидеомонитора – один в поле зрения оперирующего хирурга, другой для ассистентов. (Рис. 8).
Для постановки лапаропортов использовали 5 точек (Рис. 9). Точка 1 непосредственно над пупком по срединной линии, где устанавливался 10 мм порт для эндовидеокамеры. Точка 2- вмезогастрии, по среднеключичной линии справа для 10 мм троакара, через который выполнялись основные манипуляции на кардиальном отделе и дне желудка, абдоминальном отделе пищевода. Расположение данной точки было индивидуальным и зависело от анатомических особенностей – расположение круглой связки печени и левой доли печени.
Точка 3- под мечевидным отростком, где устанавливался 5 мм лапаропорт для ретрактора печени. Точка 4- на 2-3 см ниже левой реберной дуги по среднеключичной линии вводился 5 мм троакар для работы диссектором, аспиратором-ирригатором, иглодержателем, а также для установки контрольного дренажа после операции. Точка 5- влевой боковойобласти живота по передней подмышечной линии для 5 мм лапаропорта через который выполнялась тракция желудка зажимом Бебкокка.
Указанные места введения лапаропортов – по окружности, обеспечивали равноудаленное расположение инструментов по отношению к области оперативного вмешательства и отсутствие механического взаимодействия инструментов в брюшной полости. Оператор использовал в своей работе инструменты установленные в точках 2 и 3, первый ассистент в точках 3 и 4, второй ассистент -1 и 5.
После установки первого лапаропорта создавали пневмокарбоксиперитонеум с поддержанием давления на уровне 12-14 мм рт ст. Операцию начинали с осмотра брюшной полости для исключения сопутствующей патологии брюшной полости, оценки индивидуальных анатомических особенностей и постановки других лапаропортов. Затем выделяли переднюю поверхность абдоминального отдела пищевода и область пищеводно-желудочного перехода. Для этого проводилась послойная пристеночная мобилизация малой кривизны желудка, начиная выше верхних ветвей a. gastric sinistra, идущих перпендикулярно к ней.
Затем рассекалась пищеводно-диафрагмальная связка в области пищеводно-желудочного перехода по направлению к углу Гиса (левому ребру пищевода). Далее пищеводно-диафрагмальная связка по левому ребру пищевода рассекалась до диафрагмы, а затем вдоль диафрагмы до правого ребра пищевода (Рис. 10, 13). Таким образом, выполнялась мобилизация только передней поверхности пищевода и желудочно-пищеводного перехода, без нарушения анатомических соотношений пищевода и желудка в области угла Гиса и связочных структур между дном желудка и селезенкой, удерживающих его в исходном положении, которое в последующем способствует созданию тракции при подшивании рассеченной мышечной оболочки пищевода. Эти манипуляции выполнялись с помощью ультразвукового гармонического скальпеля «Ultrasision» или эндохирургического крючка.
Передняя поверхность пищевода и область пищеводно-желудочного перехода выделялись таким образом, чтобы на их поверхности не было жировой клетчатки (Рис. 12). Протяженность суженого сегмента пищевода определялась визуально. Если престенотическое расширение пищевода располагалось выше уровня диафрагмы, производилось её сагиттальное рассечение, чтобы выделить пищевод не менее чем на 1,5-2 см выше сужения.
На толстом желудочном зонде, эндохирургическим крючком, в режиме резания, по срединной линии передней полуокружности пищевода выполнялась передняя продольная миотомия на протяжении суженого сегмента пищевода.
На 1,5-2 см выше него и дистально до зоны интимного сращения подслизистой и мышечной оболочки кардиального отдела желудка, что соответствует пищеводно-желудочному переходу, мышцы которого составляют единый замыкательный механизм кардии, вместе с мышцами нижней трети пищевода (Рис. 13). При выполнении миотомии важным техническим моментом является полное пересечение всех циркулярных мышечных волокон.
Слизисто-подслизистый слой по левому ребру пищевода отсепаровывался от мышечной оболочки на V окружности пищевода (Рис.14), после чего слизистая оболочка начинала про лавировать между разошедшимися краями мышечного слоя (Рис. 15).
Указанный прием существенно увеличивает диаметр пищевода и предотвращает последующее смыкание рассеченных краев его мышечной оболочки. Этот эффект усиливается за счет оттягивания левого края рассеченной мышечной оболочки пищевода путем подшивания к дну желудка, которое, в некоторой степени, остается фиксированным за счет сохранения анатомических взаимоотношений в области угла Гиса и с селезенкой, которая мало смещена из-за наличия связочного аппарата с окружающими органами.
Далее передняя стенка желудка без натяжения фиксировалась швами к правому краю рассеченной мышечной оболочки. Для этого непрерывным швом снизу вверх дно желудка подшивали к левому краю рассеченной стенки пищевода, а затем сверху вниз по правому краю разреза. Шов накладывается с помощью иглодержателя неабсорбирующимся шовным материалом на атравматичной игле (Рис. 16).
На 2 сутки всем пациентам выполнялось контрольное рентгенологическое исследование для исключения нарушения целостности стенки пищевода, очем судили по отсутствию затеков контрастного вещества за контур пищевода. Подобных осложнений не выявлено ни у одного больного. После этого пациенты начинали питаться с соблюдением строгой диеты – на протяжении 25 суток после операции принимали только жидкую пищу, сисключением острой, холодной, горячей пищи. Начиная с 6 суток, в рацион включали кашицеобразную пищу. Больные выписывались на 7-9 сутки после оперативного лечения.
После видеолапароскопической кардиомиотомии с фундопликацией по Дор интраоперационные осложнения возникли у 4 больных (8,0+0,4%). При выполнении эзофагокардиомиотомии с помощью эндокрючка у них произошла перфорация слизистой оболочки пищевода. Диаметр перфоративного отверстия составил не более 2-3 мм. Осложнение возникало у пациентов с резким истончением стенки пищевода при АП III – IV стадии. Дефект слизистой оболочки зашивали наложением интракорпорального шва абсорбирующимся шовным материалом (Викрил 3-0 на круглой игле). На начальном этапе освоения эндохирургических технологий в 1 наблюдении (2,0+0,2%) потребовалась конверсия доступа (лапаротомия) из-за технических трудностей при наложении интракорпорального шва. При выполнении миотомии из открытых доступов аналогичное осложнение было у 4,0+0,4% больных.
При сопоставлении частоты и характера послеоперационных осложнений (Табл. 16), установлено, что после торакального доступа у всех больных развилась пневмония. Местных осложнений в зоне оперативного вмешательства не отмечено, что объясняется хорошей визуализацией зоны оперативного вмешательства. После операций из лапаротомного доступа осложнения возникали реже, чем после торакального. Однако у одного из больных вследствие перфорации пищевода развилась эмпиема плевры с летальным исходом. После видеолапароскопических и торакальных операций летальных исходов не было. После видеолапароскопической кардиомиотомии осложнений в раннем послеоперационном периоде не было.
У 1 больного после выписки его из стационара на 10 сутки после видеолапароскопической эзофагокардиомиотомии по Геллер с эзофагофундопликацией по Дор наступила перфорация пищевода. Приводим это наблюдение. Больной среднего возраста поступил с жалобами на затруднение прохождения по пищеводу твердой, кашицеобразной и жидкой пищи, боль за грудиной во время еды, периодически возникающее срыгивание пищей. При рентгеноскопии – пищевод содержит слизь в большом количестве, просвет его расширен до 7,0 см. В дистальном отделе пищевод конически сужен до 0,1 см, контуры четкие. Газовый пузырь желудка отсутствует. ЭФГДС – слизистая пищевода бледно-розовая. В просвете мутная жидкость, следы пищи. В дистальном отделе пищевод слегка расширен. Кардия плотно сомкнута, проходима. Поставлен диагноз: Ахалазия пищевода III стадии.
Выполнена видеолапароскопическая эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор. Во время операции произошла перфорация слизистой оболочки пищевода, которая была зашита одиночным швом. На 3 сутки после операции пациенту выполнено контрольное рентгенологическое исследование – пищевод расширен до 5 см в диаметре, кардия проходима для густой бариевой взвеси, опорожнение пищевода замедленно. Затеков контраста за контур пищевода нет. На 8 сутки больной выписан в удовлетворительном состоянии. На 10 сутки после употребления грубой, твердой пищи у больного появилась острая боль в верхних отделах живота.
Госпитализирован, при обследовании диагностирована перфорация пищевода. Выполнена лапаротомия, зашивание перфоративного отверстия пищевода, санация и дренирование брюшной полости. Гастростомия. Проводилась комбинированная антибактериальная терапия. Состояние больного стабилизировалось, но в эпигастральной области сформировался трубчатый пищеводный свищ, который самостоятельно закрылся. Через 4 месяца выполнено внебрюшинное закрытие гастростомы. Пациент стал питаться пищей любой консистенции, явлений дисфагии нет.
Время операции из открытого доступа составило 93,9+1,9 минут, при применении видеолапароскопического доступа несколько больше – 108,2+3,5 минут, р
Внимание!
Диагностирует и назначает лечение только врач при очной консультации пациента.
Новости медицины и статьи о лечении рака и профилактике болезней взрослых и детей.
Зарубежные клиники и госпитали – лечение опухолей и реабилитация за границей.
При использовании материалов сайта – активная ссылка обязательна.
Ахалазия кардии
Ахалазия кардии – это заболевание, характеризующееся постепенным развитием функциональной непроходимости пищевода на уровне пищеводно-желудочного перехода, связанной с отсутствием расслабления нижнего пищеводного сфинктера и утратой нормальной сократительной способности пищевода.
Клинически ахалазия кардии проявляется прогрессирующим нарушением функции глотания, затеканием содержимого пищевода в дыхательные пути, потерей веса, что значительно ухудшает качество жизни пациентов. При развитии стойкого сужения пищевода может возникнуть необходимость выполнения оперативных вмешательств.

МЕТОДЫ ЛЕЧЕНИЯ АХАЛАЗИИ КАРДИИ
Предложено несколько методов лечения ахалазии кардии:
- применение лекарственных средств, «способствующих» релаксации (расслаблению) нижнего пищеводного сфинктера;
- эндоскопические инъекции ботулинического токсина;
- баллонная дилатация.
Однако, как правило, все эти методы не дают стойкого функционального результата, и приносят временное облегчение. Наиболее эффективным методом лечения ахалазии кардии является хирургический (операция Геллера), суть которого заключается в рассечении волокон мышц с нарушенной функцией.
МЕТОД ПОЭМ ДЛЯ ЛЕЧЕНИЯ АХАЛАЗИИ КАРДИИ
Развитие внутрипросветной эндоскопической хирургии вдохновило гастроэнтерологов и эндоскопических хирургов на создание менее инвазивного метода лечения ахалазии кардии, не уступающего по эффективности хирургическому вмешательству.
Метод подслизистой эндоскопической миотомии пищевода (ПОЭМ) заключается в рассечении внутреннего циркулярного мышечного слоя пищевода и кардиального отдела желудка, выполняемом из подслизистого тоннеля, создаваемого через небольшой разрез слизистой оболочки грудного отдела пищевода.
ЭТАПЫ ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА ПРИ АХАЛАЗИИ КАРДИИ






Основным преимуществом ПОЭМ является отсутствие риска неконтролируемой перфорации пищевода, которая может возникнуть во время баллонной дилатации. Кроме того, данный вариант миотомии (рассечения мышц) можно выполнять на большем протяжении пищевода. ПОЭМ продемонстрировала свою относительную безопасность не только с точки зрения риска инфицирования, но и с точки зрения нарушения гемодинамики, респираторных и метаболических расстройств. Ни одна из операций не осложнилась развитием таких серьезных осложнений, как медиастинит или перитонит. Безусловно, такие вмешательства должны выполняться при использовании современного технического оснащения, наличии высокопрофессиональной анестезиологической службы и тщательного послеоперационного наблюдения за пациентами.
ЛЕЧЕНИЕ АХАЛАЗИИ КАРДИИ
Первый клинический вариант пероральной эндоскопической миотомии у человека разработал и впервые выполнил 8 сентября 2008г. профессор Х. Иноуе. В Клинике+31 начато активное применение данной методики. Первые процедуры были выполнены совместной бригадой с автором методики, а затем самостоятельно профессором Евгением Дмитриевичем Фёдоровым, и подтвердили безопасность, непосредственную эффективность метода в лечении ахалазии кардии.
Лечение ахалазии кардии методом ПОЭМ по праву считается альтернативой традиционному хирургическому вмешательству.