Аптечные формы изготовления из салициловой кислоты. Формула салициловой кислоты структурная химическая
Салициловая кислота (Salicylic acid)
Содержание
Структурная формула

Русское название
Латинское название вещества Салициловая кислота
Химическое название
Брутто-формула
Фармакологическая группа вещества Салициловая кислота
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Салициловая кислота
Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Мало растворима в холодной воде (1:500), растворима в горячей воде (1:5), легко растворима в спирте (1:3).
Фармакология
Способствует очищению раны от гнойного отделяемого и ее заживлению, ликвидирует перифокальное воспаление. Оказывает отвлекающее, кератолитическое (в высокой концентрации) и кератопластическое (в низкой концентрации) действие. Подавляет секрецию сальных и потовых желез.
Применение вещества Салициловая кислота
Монотерапия и в составе комбинированных препаратов при воспалительных, инфекционных и других поражениях кожи, в т.ч. ожоги, псориаз, экзема, дискератоз, ихтиоз, обыкновенные угри, бородавки, гиперкератоз, мозоли, омозолелость, жирная себорея, отрубевидный лишай; выпадение волос; потливость ног.
Противопоказания
Гиперчувствительность, почечная недостаточность, младенческий возраст.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — C.
Побочные действия вещества Салициловая кислота
Местное раздражение (зуд, жжение в месте нанесения), аллергические реакции.
Пути введения
Взаимодействия с другими действующими веществами
Торговые названия
- Аптечка
- Интернет-магазин
- О компании
- Контакты
- Контакты издательства:
- +7 (499) 281-91-91
- E-mail: pr@rlsnet.ru
- Адрес: Россия, 123007, Москва, ул. 5-я Магистральная , д. 12.
Официальный сайт компании РЛС ® . Главная энциклопедия лекарств и товаров аптечного ассортимента российского интернета. Справочник лекарственных препаратов Rlsnet.ru предоставляет пользователям доступ к инструкциям, ценам и описаниям лекарственных средств, БАДов, медицинских изделий, медицинских приборов и других товаров. Фармакологический справочник включает информацию о составе и форме выпуска, фармакологическом действии, показаниях к применению, противопоказаниях, побочных действиях, взаимодействии лекарств, способе применения лекарственных препаратов, фармацевтических компаниях. Лекарственный справочник содержит цены на лекарства и товары фармацевтического рынка в Москве и других городах России.
Запрещена передача, копирование, распространение информации без разрешения ООО «РЛС-Патент».
При цитировании информационных материалов, опубликованных на страницах сайта www.rlsnet.ru, ссылка на источник информации обязательна.
Еще много интересного
© РЕГИСТР ЛЕКАРСТВЕННЫХ СРЕДСТВ РОССИИ ® РЛС ® , 2000-2020.
Все права защищены.
Не разрешается коммерческое использование материалов.
Информация предназначена для медицинских специалистов.
Салициловая кислота
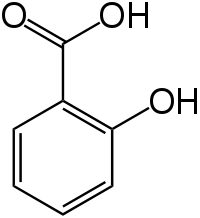
Салици́ловая кислота (от лат. salix «ива», из коры которой она была впервые выделена) — 2-гидроксибензойная или фенольная кислота, С6Н4(ОН)СООН; бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1,8 г/л при 20 °C).
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы ( Salix L. ), откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria, Spiraea digitata).
Содержание
Свойства соединения
Физические свойства
Салициловая кислота легкорастворима в этаноле, диэтиловом эфире, малорастворима в сероуглероде. Растворимость в воде (г/л): (0°C), 1,8 (20°C), 8,2 (60°C), 20,5 (80°C).
Химические свойства
Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной: в результате салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения вследствие стабилизации промежуточного σ-комплекса гидроксильной группой.
Нуклеофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,4,6-тринитрофенолу), а бромирование — к 2,4,6-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-сульфобензойную) кислоту.
При нагревании салициловая кислота декарбоксилируется до фенола, в промышленности салициловую кислоту обычно получают обратной реакцией — карбоксилированием фенолята натрия углекислым газом при 150—180 °C и давлении 5 атм (реакция Кольбе — Шмитта):
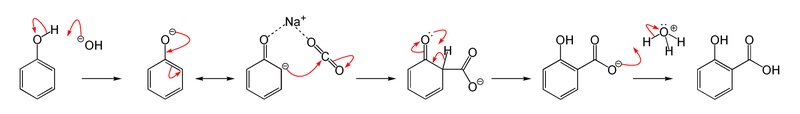
Следует обратить внимание, что такое карбоксилирование фенола, во-первых обратимо и, во-вторых, существенную роль в карбоксилирование в орто-положение к фенольному гидроксилу играет эффект взаимодействия координационной связи катиона щелочного металла с кислородными лигандами с образованием хелатообразного промежуточного состояния: так, в орто-положение с образованием салицилата карбоксилирование происходит только в случае фенолятов натрия и лития, в случае фенолятов калия, рубидия и цезия карбоксилирование идёт по пара-положению — катионы этих щелочных металлов имеют больший радиус и координационная стабилизация переходного состояния невозможна. Об обратимости реакции говорит также перегруппировка дикалиевой соли салициловой кислоты в дикалиевую соль пара-гидроксибензойной кислоты и превращение натриевой соли пара-гидроксибензойной кислоты при нагревании в динатриевую соль салициловой кислоты.
Такое хелатообразование характерно для салициловой кислоты — так, качественный метод обнаружения салициловой кислоты основан на образовании интенсивно окрашенных в сине-фиолетовый цвет комплексов с хлоридом железа (III).
Каталитическое гидрирование на платине, а также восстановление натрием в изоамиловом спирте ведёт к пимелиновой кислоте HOOC(CH2)5COOH.
Салицилаты
Салициловая кислота образует соли — салицилаты. Некоторые представители:
Физиологическая роль и действие салицилатов
Действие на человека и животных
Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженным противовоспалительным действием.
Гормон растений
Показано действие салициловой кислоты как фитогормона. Салициловая кислота вызывает повышение температуры в отдельных органах термогенных растений (в частности лилии вуду). Это происходит по причине разрыва транспорта электронов в митохондриальной дыхательной цепи. Активно изучается роль салициловой кислоты в развитии не специфической реакции на стрессогенные факторы и накопление в клетках активных форм кислорода.
Применение салициловой кислоты
Применение в медицине
Салициловая кислота — активный компонент ивовой коры. Ещё в XIX в. её использовали для лечения ревматизма и мочекислого диатеза, а сегодня это вещество синтезируют в больших количествах, так как оно служит основой для производства многих лекарств.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь». В аптечной сети продаётся в таких лекарственных формах, как спиртовой раствор для наружного применения (с содержанием салициловой кислоты 1 или 2 %) и мазь (2, 3, 5 и 10-процентная). [1]
Производные салициловой кислоты также применяются в медицине (салицилат натрия), её амид (салициламид) и ацетилсалициловую кислоту (аспирин) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; фенилсалицилат — как антисептик, пара-аминосалициловую кислоту (структурно близкую с пара-аминобензойной кислотой, необходимой туберкулезным микобактериям, и поэтому метаболически конкурирующую с ней) — как специфическое противотуберкулёзное средство.
Другие сферы применения
Благодаря антисептическому действию салициловую кислоту употребляют при консервировании пищевых продуктов; её используют также в производстве азокрасителей, душистых веществ (сложных эфиров салициловой кислоты), для колориметрических определения Fe и Cu, для отделения тория от других элементов.
Токсические свойства и требования безопасности
Салициловая кислота токсична в больших дозах, для человека предполагаемая LD50 составляет 1.75 г/кг [2] . Беременным советуют не употреблять продуктов, содержащих салицилаты, из-за повышения риска развития синдрома Рея.
Фармакопея.рф
Pharmacopoeia.ru — сайт о регистрации лекарственных средств в России. Site about registration of Drugs in Russia and EAEU (CIS).
ФС.2.1.0033.15 Салициловая кислота
Содержимое (Table of Contents)
ФС.2.1.0033.15 Салициловая кислота
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Салициловая кислота ФС.2.1.0033.15
Салициловая кислота
Acidum salicylicum Взамен ГФ X, ст. 21

Содержит не менее 99,0 % и не более 101,0 % салициловой кислоты С7Н6О3 в пересчете на сухое вещество.
Описание
Белые или бесцветные мелкие игольчатые кристаллы или легкий кристаллический порошок от белого до почти белого цвета, без запаха.
Растворимость
Легко растворим в спирте 96 %, растворим в кипящей воде, умеренно растворим в хлороформе, мало растворим в воде.
Подлинность
- ИК-спектр. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области частот от 4000 до 400 см -1 по положению полос поглощения должен соответствовать спектру стандартного образца салициловой кислоты.
- Качественная реакция. 0,01 г субстанции растворяют в 10 мл воды. Полученный раствор должен давать характерную реакцию на салицилаты (ОФС «Общие реакции на подлинность»).
- Качественная реакция. 1,0 г субстанции нагревают с 2 мл серной кислоты концентрированной и выделяющийся газ пропускают через раствор кальция гидроксида; должно появиться помутнение раствора.
Температура плавления
Родственные примеси
Определение проводят методом ВЭЖХ.
Испытуемый раствор. 0,5 г субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в подвижной фазе (ПФ), доводят объём раствора ПФ до метки и перемешивают.
Раствор сравнения А. 10 мг фенола (примесь С) помещают в мерную колбу вместимостью 100 мл, растворяют в ПФ, доводят объём раствора ПФ до метки и перемешивают.
Раствор сравнения Б. 5 мг 4-гидроксибензол-1,3-дикарбоновой кислоты (примесь В) помещают в мерную колбу вместимостью 20 мл, растворяют в ПФ, доводят объём раствора ПФ до метки и перемешивают.
Раствор сравнения В. 50 мг 4-гидроксибензойной кислоты (примесь А) помещают в мерную колбу вместимостью 100 мл, растворяют в ПФ, доводят объём раствора ПФ до метки и перемешивают.
Раствор сравнения Г. 1 мл раствора сравнения А разбавляют ПФ до
10 мл и перемешивают.
Раствор для проверки пригодности хроматографической системы. Смесь 1 мл раствора сравнения А, 1 мл раствора сравнения Б и 1 мл раствора сравнения В разбавляют ПФ до 10 мл и перемешивают.
Раствор сравнения Д. 1 мл раствора для проверки пригодности хроматографической системы разбавляют ПФ до 10 мл и перемешивают.
Хроматографируют раствор сравнения Г и раствор для проверки пригодности хроматографической системы.
Относительные времена удерживания относительно фенола составляют: для 4-гидроксибензойной кислоты – около 0,70; для 4-гидроксибензол-1,3-дикарбоновой кислоты – около 0,90.
Хроматографическая система считается пригодной, если выполняются следующие условия:
— время удерживания третьего пика на хроматограмме раствора для проверки пригодности хроматографической системы соответствует времени удерживания пика фенола, полученного на хроматограмме раствора сравнения Г;
— на хроматограмме раствора для проверки пригодности хроматографической системы разрешение (R) между пиками 4-гидроксибензол-1,3-дикарбоновой кислоты и фенола не менее 1,0. Для достижения необходимого разрешения возможно изменить количество уксусной кислоты ледяной в составе подвижной фазы.
Хроматографируют испытуемый раствор и раствор сравнения Д.
На хроматограмме испытуемого раствора площадь пика 4-гидроксибен-зойной кислоты должна быть не более площади соответствующего пика на хроматограмме раствора сравнения Д (не более 0,1 %), площадь пика
4-гидроксибензол-1,3-дикарбоновой кислоты должна быть не более площади соответствующего пика на хроматограмме раствора сравнения Д (не более 0,05 %), площадь пика фенола должна быть не более площади соответствующего пика на хроматограмме раствора сравнения Д (не более 0,02 %), площадь пика любой другой примеси должна быть не более площади пика 4-гидроксиизофталевой кислоты на хроматограмме раствора сравнения Д (не более 0,05 %). Сумма примесей должна быть не более 0,2 %. Не учитывают пики, площадь которых составляет менее 1,0 % от площади основного пика на хроматограмме раствора сравнения Д.
Хлориды
Не более 0,004 % (ОФС «Хлориды»). 1,5 г субстанции растворяют в 30 мл кипящей воды, охлаждают и фильтруют. Для анализа отбирают 10 мл полученного раствора.
Сульфаты
Не более 0,02 % (ОФС «Сульфаты»). Для определения используют раствор, полученный в испытании «Хлориды».
Сульфатная зола
Не более 0,1 % (ОФС «Сульфатная зола»). Для определения используют около 0,5 г (точная навеска) субстанции.
Тяжелые металлы
Не более 0,002 %. Определение проводят в соответствии с требованиями ОФС «Тяжёлые металлы» в зольном остатке, полученном после сжигания 0,5 г субстанции (ОФС «Сульфатная зола»).
Железо
Не более 0,006 % (ОФС «Железо»). Для определения используют сульфатную золу из 0,5 г субстанции.
Потеря в массе при высушивании
Не более 0,5 % (ОФС «Потеря в массе при высушивании», способ 1). Около 1,0 г субстанции (точная навеска) высушивают до постоянной массы при температуре 60 ºС.
Микробиологическая чистота
Количественное определение
Около 0,12 г (точная навеска) субстанции растворяют в 30 мл спирта 96 %, прибавляют 20 мл воды и титруют 0,1 М раствором натрия гидроксида (индикатор – 0,1 мл 0,1 % раствора фенолового красного) до появления красновато-фиолетовой окраски.
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора натрия гидроксида соответствует 13,81 мг салициловой кислоты С7Н6О3.
Хранение
В хорошо укупоренной упаковке, в защищённом от света месте.
Аптечные формы изготовления из салициловой кислоты. Формула салициловой кислоты структурная химическая


Химический состав Салициловой кислоты
Молекулярная масса: 138,122
Салици́ловая кислота (от лат. salix «ива», из коры которой она была впервые выделена) — 2-гидроксибензойная или фенольная кислота, С6Н4(ОН)СООН; бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1,8 г/л при 20 °C). Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
Распространение в природе
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы, откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria, Spiraea digitata).
2-оксибензойную (салициловую) кислоту получают из фенолята натрия и углекислого газа в автоклавах при 180° С с последующей обработкой продукта реакции соляной кислотой (реакция Кольбе — Шмитта).
Салициловая кислота легкорастворима в этаноле, диэтиловом эфире, малорастворима в сероуглероде. Растворимость в воде (г/л): (0 °C), 1,8 (20 °C), 8,2 (60 °C), 20,5 (80 °C).
Является двухосновной кислотой (очень слабой по второй ступени): pK1 = 2,97 pK2 = 13,82. Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной: в результате салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения вследствие стабилизации промежуточного σ-комплекса гидроксильной группой. Электрофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,4,6-тринитрофенолу), а бромирование — к 2,4,6-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-сульфобензойную) кислоту. При нагревании салициловая кислота декарбоксилируется до фенола, в промышленности салициловую кислоту обычно получают обратной реакцией — карбоксилированием фенолята натрия углекислым газом при 150—180 °C и давлении 5 атм (реакция Кольбе — Шмитта). Следует обратить внимание, что такое карбоксилирование фенола, во-первых обратимо и, во-вторых, существенную роль в карбоксилировании в орто-положение к фенольному гидроксилу играет эффект взаимодействия координационной связи катиона щелочного металла с кислородными лигандами с образованием хелатообразного промежуточного состояния: так, в орто-положение с образованием салицилата карбоксилирование происходит только в случае фенолятов натрия и лития, в случае фенолятов калия, рубидия и цезия карбоксилирование идёт по пара-положению — катионы этих щелочных металлов имеют больший радиус и координационная стабилизация переходного состояния невозможна. Об обратимости реакции говорит также перегруппировка дикалиевой соли салициловой кислоты в дикалиевую соль пара-гидроксибензойной кислоты и превращение натриевой соли пара-гидроксибензойной кислоты при нагревании в динатриевую соль салициловой кислоты. Такое хелатообразование характерно для салициловой кислоты — так, качественный метод обнаружения салициловой кислоты основан на образовании интенсивно окрашенных в сине-фиолетовый цвет комплексов с хлоридом железа. Каталитическое гидрирование на платине, а также восстановление натрием в изоамиловом спирте ведёт к пимелиновой кислоте HOOC(CH2)5COOH.
Салициловая кислота образует соли — салицилаты. Некоторые представители:
- Натрия салицилат
- Салицилат аммония
Физиологическая роль и действие салицилатов
Действие на человека и животных
Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженным противовоспалительным действием.
Показано действие салициловой кислоты как фитогормона. Салициловая кислота вызывает повышение температуры в отдельных органах термогенных растений (в частности у некоторых представителей семейства Ароидных). Это происходит по причине разрыва транспорта электронов в митохондриальной дыхательной цепи. Активно изучается роль салициловой кислоты в развитии неспецифической реакции на стрессогенные факторы и накопление в клетках активных форм кислорода.
Применение салициловой кислоты
Применение в медицине
Салициловая кислота — активный компонент ивовой коры. Ещё в XIX в. её использовали для лечения ревматизма и мочекислого диатеза, а сегодня это вещество синтезируют в больших количествах, так как оно служит основой для производства многих лекарств. Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь». В аптечной сети продаётся в таких лекарственных формах, как спиртовой раствор для наружного применения (с содержанием салициловой кислоты 1 или 2 %) и мазь (2, 3, 5 и 10-процентная). Производные салициловой кислоты также применяются в медицине (салицилат натрия), её амид (салициламид) и ацетилсалициловую кислоту (аспирин) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; фенилсалицилат — как антисептик, пара-аминосалициловую кислоту (структурно близкую с пара-аминобензойной кислотой, необходимой туберкулезным микобактериям, и поэтому метаболически конкурирующую с ней) — как специфическое противотуберкулёзное средство.
Другие сферы применения
- Благодаря антисептическому действию салициловую кислоту используют при консервировании пищевых продуктов;
- Производство азокрасителей, душистых веществ (сложных эфиров салициловой кислоты);
- Колориметрическое определение Fe и Cu, для отделения тория от других элементов.
Токсические свойства и требования безопасности
Салициловая кислота токсична в больших дозах, для человека предполагаемая LD50 составляет 1.75 г/кг. Беременным советуют не употреблять продуктов, содержащих салицилаты, из-за повышения риска развития синдрома Рея. В организме человека салициловая кислота метаболизируется, образуя конъюгаты с глюкуроновой кислотой (о-гидроксибензоилглюкуронид и о-карбоксифенилглюкуронид) и глицином, либо путём гидроксилирования до 2,3- и 2,5-дигидроксибензойной и 2,3,5-тригидроксибензойной кислот. Салициловая кислота и её метаболиты выводятся из организма с мочой.



