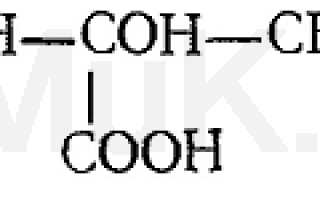Чужеродные химические вещества. Превращение чужеродных веществ Обезвреживает чужеродные вещества
§ 9. МЕТАБОЛИЗМ ЧУЖЕРОДНЫХ СОЕДИНЕНИЙ
Вещества, поступившие в организм с пищей, а также лекарственные и другие соединения под влиянием ферментов подвергаются различным превращениям. Процесс превращения поступивших в организм веществ называется метаболизмом, или биотрансформацией, а вещества, образующиеся при этих превращениях, называются метаболитами.
Белки, жиры, углеводы, гормоны, витамины и некоторые другие вещества, поступившие в организм, являются свойственными организму. Они служат источником энергии или являются структурными элементами для создания клеток, тканей и т. д. Свойственные организму вещества подвергаются метаболизму с помощью специфических ферментных систем, обеспечивающих жизнь тканей и деятельность организма.
Кроме свойственных организму веществ в него могут поступать лекарственные препараты, пищевые добавки, химические средства защиты растений, предметы бытовой химии и многие другие вещества, которые не свойственны организму. Они не обеспечивают энергией все нуждающиеся в ней формы жизнедеятельности и не превращаются в компоненты клеток и тканей. В определенных условиях эти вещества могут нарушать нормальные процессы метаболизма белков, жиров и других свойственных организму соединений, вызывать отравления и даже смерть. Такие вещества называются чужеродными, или ксенобиотиками. Ниже остановимся только на описании метаболизма чужеродных соединений.
Преобладающее число метаболитов является менее токсичным, чем чужеродные вещества, из которых они образовались. Метаболиты легко выводятся из организма. Поэтому метаболизм лекарственных веществ и особенно ядов является одним из путей детоксикации.- В связи с этим изучение метаболизма представляет большой интерес для фармакологов, токсикологов, клиницистов и специалистов ряда других отраслей науки.
Интерес химиков-токсикологов к изучению метаболизма ядовитых веществ объясняется рядом причин. Некоторые лекарственные вещества и яды быстро метаболизируются в организме и могут быть обнаружены только в виде метаболитов.
Физические и химические свойства большинства метаболитов
отличаются от свойств чужеродных соединений, из которых они образовались. Поэтому методы выделения чужеродных соединений из биологического материала, применяемые в химико-токсикологическом анализе, во многих случаях не пригодны для выделения метаболитов. Не располагая соответствующими методами выделения метаболитов из биологического материала в ходе анализа объектов биологического происхождения на наличие ядов, химики-токсикологи частично или полностью могут потерять метаболиты.
Из-за частичной или полной потери метаболитов в ходе химико-токсикологического анализа заключение химиков-экспертов о наличии и количестве яда в соответствующих органах или биологических жидкостях не могут отражать истинного содержания искомого вещества, поступившего в исследуемые объекты.
Для более полного представления о количестве яда, вызвавшего отравление, при химико-токсикологическом анализе необходимо производить идентификацию и количественное определение не только ядовитого вещества, но и его метаболитов. Однако методы обнаружения и количественного определения многих метаболитов еще не разработаны или разработаны недостаточно.
До настоящего времени достигнуты определенные успехи в области изучения метаболизма ряда лекарственных веществ и ядов. Однако метаболизм этих веществ еще не изучен или изучен недостаточно. В литературе имеются противоречивые данные о метаболитах отдельных ядов. Большинство результатов экспериментальных исследований, посвященных изучению метаболизма чужеродных соединений, приведено в малодоступных источниках литературы. Имеется ограниченное число монографий на русском языке, посвященных метаболизму чужеродных соединений.
Методам анализа метаболитов посвящена книга Ж. Хирца, которая представляет большой интерес для химиков-аналитиков и судебных химиков, изучающих методы исследования ядов и их метаболитов. Однако эта книга не может быть руководством для специалистов указанных областей знаний. В ней приведена сводка методик анализа метаболитов без подробного описания основных этапов их исследования.
Учитывая большое значение методов анализа метаболитов для определения ядов, которые могут вызвать отравление, разработка указанных методов имеет теоретическое и практическое значение. Однако решение указанной задачи связано с некоторыми затруднениями.
Основное затруднение при исследовании метаболитов состоит в том, что они находятся в биологическом материале в малых количествах, для анализа которых требуются специальные методы. Поэтому из объектов биологического происхождения, содержащих различные по химическому составу и свойствам вещества (белки, продукты их разложения и др.), трудно выделить метаболиты количественно. Для выделения метаболитов из биологического материала необходимо применять методы, связанные с проведением ряда сложных, а иногда и трудоемких операций, при выполнении которых может теряться определенное количество этих веществ.
Количество метаболитов, выделяемых из биологического материала с помощью соответствующих методов, в ряде случаев является недостаточным для определения элементного состава, функциональных групп, химического строения, физических и химических свойств выделенных веществ.
Метаболиты, выделенные из биологического материала, необходимо подвергать исследованию с помощью соответствующих реакций и методов. Результаты этих исследований необходимо сравнивать с результатами исследований заведомо известных соединений. Такие соединения в большинстве случаев отсутствуют в химических лабораториях. Их нужно получать синтетическим путем. Синтез предполагаемых метаболитов, как правило, является довольно сложным. Поэтому вопросы исследования метаболитов иногда должны решаться совместно химиками-аналитиками и химиками-синтетиками.
Несмотря на затруднения, возникающие при изучении метаболизма, в этой области уже получены определенные результаты, позволяющие установить состав и строение многих метаболитов и вывести некоторые общие закономерности процессов биотрансформации.
Метаболизм чужеродных соединений (лекарственных препаратов, ядов и др.) в организме людей и животных происходит под влиянием ферментных систем. Большинство из ядов метабо-лизируется в печени, в которой продуцируется значительное число ферментов. Эти ферменты локализуются в митохондриях, микросомах, лизосомах клеток печени. Метаболиты, образующиеся в печени, поступают в желчь, затем в кишки и выводятся с калом или поступают в почки и выделяются с мочой. Метаболизм чужеродных соединений частично происходит в почках, легких, пищевом канале, коже и др.
Многие ферменты, под влиянием которых происходит метаболизм чужеродных соединений, присущи организму. Они катализируют превращение близких по химической природе веществ. Однако некоторые ферменты, необходимые для превращения чужеродных веществ, отсутствуют в организме, но образуются в’процессе метаболизма. В этих случаях чужеродные соединения индуцируют образование ферментов, которые катализируют их метаболизм, Такие ферменты называются индуцированными.
В процессе метаболизма под влиянием ферментов чужеродные соединения подвергаются ряду превращений, в результате которых образуются метаболиты. В молекулах метаболитов содержатся определенные функциональные группы, от наличия которых зависит полярность и растворимость этих веществ. Как правило, метаболиты являются более полярными, чем чужеродные вещества, из которых они образовались. С увеличением полярности метаболитов возрастает их растворимость в воде. Это обстоятельство приводит к увеличению возможности выделения метаболитов из организма через почки с мочой.
За небольшим исключением метаболиты являются менее токсичными, чем чужеродные соединения, из которых они образовались. Таким образом, метаболизм является одним из путей дезактивирования (дезинтоксикации) чужеродных соединений в организме.
Однако в ряде случаев метаболиты могут быть более токсичными, чем чужеродные соединения, из которых они образовались. Известно, что гексаметилентетрамин не обладает антибактериальной активностью, а его метаболит — формальдегид — проявляет указанную активность и является токсичным. Метиловый спирт имеет значительно меньшую токсичность, чем формальдегид, являющийся метаболитом этого спирта. При метаболизме кодеина может образовываться морфин, более токсичный, чем кодеин. Хлоралгидрат проявляет снотворное действие только после превращения его в более токсичный метаболит — трихлорэтанол. Метаболитом фенацетина является парацетамол, который имеет более выраженное фармакологическое действие на организм, чем фенацетин. Примеров образования метаболитов более токсичных, чем чужеродные соединения, можно привести еще много.
Более токсичными, чем исходные вещества, являются продукты летального синтеза. При летальном синтезе из более простых чужеродных соединений в организме образуются более сложные соединения, обладающие токсическим действием. Это можно показать на таком примере: нетоксичная фторуксусная кислота F—СН 2 —СООН в организме подвергается синтезу, в результате которого образуется фторлимонная кислота
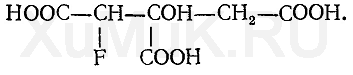
На метаболизм чужеродных соединений влияют различные факторы. Метаболизм одних и тех же чужеродных соединений в организме людей может протекать не так, как в организме некоторых животных. Изменения метаболизма чужеродных веществ могут зависеть от возраста, пола, питания, различных заболеваний, стрессовых состояний, наличия других чужеродных соединений в организме и некоторых других факторов.
Метаболизм ряда чужеродных соединений происходит в две фазы. В первой фазе под влиянием ферментных систем чужеродные соединения превращаются в их метаболиты. Во второй фазе метаболиты и некоторые чужеродные соединения с определенными веществами, находящимися в организме, образовывают конъюгаты.
В первой фазе метаболизма под влиянием ферментных систем чужеродные соединения могут подвергаться окислению, восстановлению, гидролизу, дезаминированию, дезалкилирова-нию, десульфированию и другим превращениям.
Чужеродными химическими веществами
Чужеродные химические вещества (ЧХВ) называются еще ксенобиотиками (от греч. xеnоs – чужой). Они включают соединения, которые по своему характеру и количеству не присущи натуральному продукту, но могут быть добавлены с целью совершенствования технологии, сохранения или улучшения качества продукта или же они могут образоваться в продукте в результате технологической обработки и хранения, а также при попадании загрязнений из окружающей среды. Из окружающей среды в организм человека с пищей поступает 30-80 % от общего количества чужеродных химических веществ.
Чужеродные вещества можно классифицировать по характеру действия, токсичности и степени опасности.
Похарактеру действия ЧХВ, поступающие в организм с пищей, могут:
· оказывать общетоксическое действие;
· оказывать аллергическое действие (сенсибилизировать организм);
· оказывать канцерогенное действие (вызывать злокачественные опухоли);
· оказывать эмбриотоксическое действие (влияние на развитие беременности и плода);
· оказывать тератогенное действие (пороки развития плода и рождение потомства с уродствами);
· оказывать гонадотоксическое действие (нарушать репродуктивную функцию, т.е. нарушать функцию воспроизводства);
· понижать защитные силы организма;
· ускорять процессы старения;
· неблагоприятно влиять на пищеварение и усвоение пищевых веществ.
Потоксичности, характеризующей способность вещества причинять вред организму, учитывают дозу, частоту, способ поступления вредного вещества и картину отравления.
По степени опасности чужеродные вещества подразделяют на чрезвычайно токсичные, высокотоксичные, умереннотоксичные, малотоксичные, практически нетоксичные и практически безвредные.
Наиболее изучено острое воздействие вредных веществ, оказывающих непосредственное действие. Особенно трудно оценить хроническое воздействие ЧХВ на организм человека и их отдаленные последствия.
Вредное действие на организм могут оказывать:
· продукты, содержащие пищевые добавки (красители, консерванты, антиокислители и др.) – неапробированные, неразрешенные или используемые в повышенных дозах;
· продукты или отдельные пищевые вещества, полученные по новой технологии, путем химического или микробиологического синтеза, не апробированные или изготовленные с нарушением технологии или из некондиционного сырья;
· остаточные количества пестицидов, содержащиеся в продуктах растениеводства или животноводства, полученных с использованием кормов или воды, загрязненных высокими концентрациями пестицидов или в связи с обработкой ядохимикатами животных;
· продукты растениеводства, полученные с использованием неапробированных, неразрешенных или нерационально применяемых удобрений и оросительных вод (минеральные удобрения и другие агрохимикаты, твердые и жидкие отходы промышленности и животноводства, хозяйственно-бытовые сточные воды, осадки из очистных сооружений и др.);
· продукты животноводства и птицеводства, полученные с использованием неапробированных, неразрешенных или неправильно примененных кормовых добавок и консервантов (минеральные и азотистые добавки, стимуляторы роста – антибиотики, гормональные препараты и др.). К этой группе относят загрязнение продуктов, связанное с ветеринарно-профилактическими и терапевтическими мероприятиями (антибиотики, антигельминтные и другие медикаменты);
· токсиканты, мигрировавшие в продукты из оборудования, посуды, инвентаря, тары, упаковок при использовании не апробированных или неразрешенных пластмасс, полимерных, резиновых или других материалов;
· токсические вещества, образующиеся в пищевых продуктах при тепловой обработке, копчении, жарении, ферментной обработке, облучении ионизирующей радиацией и др.;
· пищевые продукты, содержащие токсические вещества, мигрировавшие из окружающей среды: атмосферного воздуха, почвы, водоемов (тяжелые металлы, диоксины, полициклические ароматические углеводороды, радионуклиды и т.д.). В эту группу входит наибольшее количество ЧХВ.
Одним из возможных путей поступления ЧХВ из окружающей среды в продукты питания является включение их в «пищевую цепь».
«Пищевые цепи» представляют собой одну из основных форм взаимосвязи между отдельными организмами, каждый из которых служит пищей для других видов. В этом случае происходит непрерывный ряд превращений веществ в последовательных звеньях «жертва-хищник». Основные варианты таких цепей представлены на рис. 2. Наиболее простыми могут считаться цепи, при которых загрязнители поступают из почвы в растительные продукты (грибы, зелень, овощи, фрукты, зерновые культуры) в результате полива растений, обработке пестицидами и пр., накапливаются в них, а затем с пищей поступают в организм человека.
Более сложными являются «цепи», при которых имеется несколько звеньев. Например, трава – травоядные животные – человек или зерно – птицы и животные – человек. Наиболее сложные «пищевые цепи», как правило, связаны с водной средой.

Рис. 2. Варианты поступления ЧХВ в организм человека через пищевые цепи
 Растворенные в воде вещества извлекаются фитоплактоном, последний затем поглощается зоопланктоном (простейшими, рачками), далее поглощается «мирными» и затем хищными рыбами, поступая с ними в организм человека. Но цепь может быть продолжена за счет поедания рыбы птицами и всеядными животными и лишь потом вредные вещества поступают в организм человека.
Растворенные в воде вещества извлекаются фитоплактоном, последний затем поглощается зоопланктоном (простейшими, рачками), далее поглощается «мирными» и затем хищными рыбами, поступая с ними в организм человека. Но цепь может быть продолжена за счет поедания рыбы птицами и всеядными животными и лишь потом вредные вещества поступают в организм человека.
Особенностью «пищевых цепей» является то, что в каждом последующем ее звене происходит кумуляция (накопление) загрязнителей в значительно большем количестве, чем в предыдущем звене. Так, в грибах концентрация радиоактивных веществ может быть в 1 000-10 000 раз выше, чем в почве. Таким образом, в пищевых продуктах, поступающей в организм человека, могут содержаться очень большие концентрации ЧХВ.
В целях охраны здоровья человека от вредного влияния чужеродных веществ, попадающих в организм с пищей, устанавливаются определенные пределы, гарантирующие безопасность использования продуктов, в которых присутствуют посторонние вещества.
К основным принципам охраны окружающей среды и пищевых продуктов от чужеродных химических веществ относятся:
· гигиеническое нормирование содержания химических веществ в объектах окружающей среды (воздухе, воде, почве, пищевых продуктах) и разработка на их основе санитарного законодательства (санитарные правила и др.);
· разработка новых технологий в различных отраслях промышленности и сельского хозяйства, минимально загрязняющих окружающую среду (замена особо опасных химических веществ менее токсичными и нестабильными в окружающей среде; герметизация и автоматизация производственных процессов; переход на безотходные производства, замкнутые циклы и др.);
· внедрение на предприятиях эффективных санитарно-технических устройств для снижения выбросов вредных веществ в атмосферу, обезвреживания сточных вод, твердых отходов др.;
· разработка и внедрение при строительстве плановых мероприятий, предупреждающих загрязнение окружающей среды (выбор площадки для строительства объекта, создание зоны санитарной охраны и др.);
· осуществление государственного санитарно-эпидемиологического надзора за объектами, загрязняющими атмосферный воздух, водоемы, почву, продовольственное сырье;
· осуществление государственного санитарно-эпидемиологического надзора за объектами, где может произойти загрязнение пищевого сырья и продуктов питания ЧХВ (предприятия пищевой промышленности, сельскохозяйственные предприятия, продовольственные склады, предприятия общепита и др.).
Превращение чужеродных веществ
 Как известно почти все попадающие в организм чужеродные вещества, в том числе лекарства, метаболизируются в нем и затем выводятся. Известно, что отдельные индивиды отличаются друг от друга скоростью метаболизации лекарств и вывода их из организма: в зависимости от природы химического вещества эта разница может быть от 4- до 40-кратной. При медленной метаболизации и выводе определенное лекарство может накапливаться в организме и, наоборот, некоторые индивиды могут быстро выводить чужеродное вещество из организма.
Как известно почти все попадающие в организм чужеродные вещества, в том числе лекарства, метаболизируются в нем и затем выводятся. Известно, что отдельные индивиды отличаются друг от друга скоростью метаболизации лекарств и вывода их из организма: в зависимости от природы химического вещества эта разница может быть от 4- до 40-кратной. При медленной метаболизации и выводе определенное лекарство может накапливаться в организме и, наоборот, некоторые индивиды могут быстро выводить чужеродное вещество из организма.
Выводу чужеродных веществ способствуют меболизирующие их ферменты. Однако наличие последних в организме зависит прежде всего от наследственных факторов, хотя на их активность могут повлиять возраст, пол, пища, болезни и т. п.
Согласно обоснованному предположению, человек, ферментная система которого быстрее и в большей мере превращает канцерогены в их ультимативные формы, более склонен к заболеванию раком, чем человек, медленнее метаболизирующий канцерогены. И в этом случае были обнаружены очень большие различия между отдельными индивидами. Например, активность фермента эпоксидгидратазы, метаболизирующей канцерогенные ПАУ, который обнаружен в микросомах печени более семидесяти индивидов, у человека с наиболее высокой степенью метаболизма может в 17 раз превышать его активность у человека с наиболее низкой степенью обмена веществ. Другие, связанные с метаболизмом канцерогенов ферменты также обнаруживают большую межиндивидную разницу.
При этом следует помнить, что по своему действию эти ферменты очень различаются друг от друга в разных тканях одного и того же индивида (легких, печени или клетках крови). Но их активность может меняться также в одной и той же ткани одного индивида (вследствие старения, под влиянием болезни, в результате действия лекарств, под влиянием пищи или индукции ферментов). Не стоит особо подчеркивать также, что активность связанных с метаболизмом канцерогенов ферментов в тканях различных животных различна; еще больше различие между тканями животных и человека.
Однако исследователи все же попытались приблизительно определить канцерогенную опасность для отдельных индивидов на основе действия ферментов, превращающих вредные вещества в организме в их ультимативные формы (так называемая метаболическая активация). Предполагают, хотя это предположение и не совсем обоснованно, что активность токсических и обезвреживающих канцерогены ферментов в лимфоцитах крови отражает состояние ферментов также в других тканях.
При определении действия бензо[a]пиренгидроксилазы установлено, что в гомогенатах лимфоцитов курильщиков его содержится на 52 % больше, чем в аналогичных гомогенатах некурящих. Обнаружена также более высокая активность этого фермента, вызывающая метаболическую активацию ПАУ, в микросомах лимфоцитов курящих и индивидов, принимавших лекарство (до 93 %). Но одновременно выяснено, что активность фермента глутатион-S-трансферазы, обезвреживающего ПАУ в организме, в гомогенате лимфоцитов всех групп (курящих, некурящих и индивидов, принимавших лекарства) оставалась примерно одинаковой. Из этого можно сделать два вывода:
- Курение влияет не только на легкие. Оно может также вызвать изменение в других тканях, например лимфоцитах крови. Это значит, что о готовности одной ткани метаболизировать канцерогены можно было бы судить лишь на основе определения активности соответствующих ферментов в других тканях, например лимфоцитах.
- В то время как курение повышает активность «токсического» фермента АГГ, активность «обезвреживающего» фермента глутатион-β-трансферазы остается неизменной. Это могло бы означать, что у курящих метаболической активации подвергается большая часть присутствующих канцерогенов, между тем как обезвреживающая активность не изменяется. Этим можно было бы, в самых общих чертах, объяснить тот факт, что у курильщиков частота заболевания раком выше, чем у некурящих, причем не только в результате повышенного поступления канцерогенов, но и благодаря повышенной активности ферментов, превращающих канцерогены в их ультимативные формы.
Ферменты и их индукция
Таким образом, можно вполне обоснованно предположить, что индивиды, у которых наблюдается высокая активность ферментов, превращающих химические канцерогены в их ультимативные производные, обнаруживают более высокую восприимчивость к раку, чем другие. Следовательно, выявление лиц с повышенной активностью таких токсических ферментов позволило бы отобрать тех, у кого высока опасность возникновения рака. Проведение соответствующих профилактических мер для таких индивидов – исключение их контакта с химическими канцерогенами, прием предохраняющих от рака лекарств – позволило бы добиться снижения заболеваемости.
Активизация этих ферментов (например, АГГ, бензо[а]пиренгндроксилаза) могла бы быть следствием наследственных свойств определенного индивида, либо обусловлена индукцией, т. е. повышением активности этих ферментов некоторыми химическими веществами. Д. В. Небарт предполагает наличие у мыши генного локуса Аг, который отвечает за обеспечение такой системой ферментов. Организм животных, обладающих этим генетическим признаком (локусом Аг), реагирует на канцерогенные ПАУ их ускоренной метаболизацией и, следовательно, повышенной заболеваемостью раком. И наоборот, у животных, не обладающих этим наследственным признаком, метаболизм очень замедлен и заболеваемость низка. Можно предположить, что подобные генетические признаки существуют и у других видов животных или человека.
Другим фактором, который мог бы повысить риск возникновения этой болезни путем повышения-активности токсических ферментов, являются индуцирующие химические вещества. К ним относятся, например, полихлорированные бмферменты, которые сами не канцерогенны, но, усиливая активность токсических ферментов, индуцируя их, могут способствовать усилению опасности канцерогенеза v индивидов, подверженных их действию.
Таким образом, выявление тех индивидов, которые характеризуются предположительно более высокой подверженностью заболеванию раком в результате контакта с химическими канцерогенами, можно было бы проводить путем установления активности какого-либо токсического фермента (например, бензо[а]-пиренгидроксилазы) в лимфоцитах их кропи. Такая проверка технически очень трудно осуществима, она, к тому же, согласно данным многих исследователей, весьма ненадежна. Как уже говорилось, очень трудно на основе активности одного фермента в лимфоцитах судить об активности нескольких ферментов в других тканях, особенно если она легко изменяется пол действием других химических веществ, возраста, пищи, болезней и других факторов. Следовательно, осторожность в определении опасности возникновения рака у отдельных людей на основе активности ферментов в их клетках вполне оправданна.
Чужеродные химические вещества. Превращение чужеродных веществ Обезвреживает чужеродные вещества
Печень — самая крупная железа пищеварительного тракта. Она выполняет в организме функцию биохимической лаборатории и играет важную роль в белковом, углеводном и липидном обменах (см. ниже). В печени синтезируются важнейшие белки плазмы крови: альбумин, фибриноген, протромбин, церулоплазмин, транс- феррин, ангиотензиноген и др. Через эти белки опосредуется участие печени в таких важных процессах, как поддержание онкотического давления, регуляция АД и объёма циркулирующей крови, свёртывание крови, метаболизм железа и др.
Важнейшая функция печени — детоксикационная (или барьерная). Она имеет существенное значение для сохранения жизни организма. В печени происходит обезвреживание таких веществ, как билирубин и продукты катаболизма аминокислот в кишечнике, а также инактивируются лекарственные препараты и токсические вещества экзогенного происхождения, NН3 — продукт азотистого обмена, который в результате ферментативных реакций превращается в нетоксичную мочевину, гормоны и биогенные амины.
Вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей организма или как источники энергии, называют чужеродными веществами, или ксенобиотиками. Эти вещества могут попадать в организм с пищей, через кожу или с вдыхаемым воздухом.
Чужеродные вещества, или ксенобиотики, делят на 2 группы:
• продукты хозяйственной деятельности человека (промышленность, сельское хозяйство, транспорт);
• вещества бытовой химии — моющие средства, вещества для борьбы с насекомыми, парфюмерия.
Гидрофильные ксенобиотики выводятся из организма в неизменённом виде с мочой, гидрофобные могут задерживаться в тканях, связываясь с белками или образуя комплексы с липидами клеточных мембран. Со временем накопление в клетках тканей чужеродного вещества приведёт к нарушению их функций. Для удаления таких ненужных для организма веществ в процессе эволюции выработались механизмы их детоксикации (обезвреживания) и выведения из организма.
Основные функции печени
Синтез и распад гликогена
Обмен липидов и их производных
Синтез жирных кислот и жиров из углеводов
Синтез и выведение холестерина
Синтез жёлчных кислот 25-гидроксилирование витамина
Синтез белков плазмы крови (включая некоторые факторы свёртывания крови)
Синтез мочевины (обезвреживание аммиака)
Метаболизм и выделение стероидных гормонов
Метаболизм полипептидных гормонов
Метаболизм и экскреция билирубина
Лекарства и чужеродные вещества
Метаболизм и экскреция
I. Механизмы обезвреживания ксенобиотиков
Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы (рис. 12-1). В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями.
Рис. 12-1. Метаболизм и выведение ксенобиотиков из организма. RH — ксенобиотик; К — группа, используемая при конъюгации (глутатион, глюкуронил и др.); М — молекулярная масса. Из множества цитохром Р450-зависимых реакций на рисунке приведена только одна — схема гидроксилирования ксенобиотика. В ходе первой фазы в структуру вещества RH вводится полярная группа ОН – . Далее происходит реакция конъюгации; конъюгат в зависимости от растворимости и молекулярной массы удаляется либо почками, либо с фекалиями.

Система обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован.
Микросомальные ферменты катализируют реакции С-гидроксилирования, Nгидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования (табл. 12-1).
Таблица 12-1. Возможные модификации ксенобиотиков в первой фазе обезвреживания

В мембранах ЭР практически всех тканей локализована система микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк — микросому, отсюда и название — микросомальное окисление. Эта система обеспечивает первую фазу обезвреживания большинства гидрофобных веществ. В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации.
Вторая фаза — реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными системами ЭР, связывается с эндогенными субстратами — глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
А. Микросомальное окисление
Микросомальные оксидазы — ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
1. Основные ферменты микросомальных электронтранспортных цепей
Микросомальная система не содержит растворимых в цитозоле белковых компонентов, все ферменты — мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Система включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов — NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент — стеароил-КоА-десатуразу.
Электронтранспортная цепь — NADPH-P450 редуктаза — цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NADPH-P450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента — флавинадениндинуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450 (см. схему ниже).


Цитохром Р450 — гемопротеин, содержит простетическую группу гем и имеет участки связывания для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм.
Окисляемый субстрат (донор электронов) для NADH-цитохром b5-редуктазы — NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe 3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды (рис. 12-2).
Рис. 12-2. Электронтранспортные цепи ЭР. RН — субстрат цитохрома Р450; стрелками показаны реакции переноса электронов. В одной системе NАDРH окисляется NАDРHцитохром Р450-редуктазой, которая затем передаёт электроны на целое семейство цитохромов Р450. Вторая система включает в себя окисление NАDН цитохром b5-редуктазой, электроны переходят на цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на O2.

NADH-цитохром b5 редуктаза — двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу — кофермент FAD, а единственный гидрофобный «хвост» закрепляет белок в мембране.
Цитохром b5 — гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий «заякоренный» в липидном бислое спирализованный домен.
NАDН-цитохром b5-редукгаза и цитохром b5, являясь «заякоренными» белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
2. Функционирование цитохрома Р450
Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционноспособным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная система, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RН и молекулы кислорода повышает окислительную активность фермента. Один атом кислорода принимает 2 e и переходит в форму О 2- . Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О 2- взаимодействует с протонами: О 2- + 2Н + —> Н2O, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH (рис. 12-3).
Рис. 12-3. Транспорт электронов при монооксигеназном окислении с участием Р450. Связывание (1) в активном центре цитохрома Р450 вещества RН активирует восстановление железа в геме — присоединяется первый электрон (2). Изменение валентности железа увеличивает сродство комплекса Р450-Fе 2+ • RН к молекуле кислорода (3). Появление в центре связывания цитохрома Р450 молекулы O2 ускоряет присоединение второго электрона и образование комплекса Р450-Fе 2+ О2–RН (4). На следующем этапе (5) Fе 2+ окисляется, второй электрон присоединяется к молекуле кислорода Р450-Fе 3+ О2 2- . Восстановленный атом кислорода (О 2- ) связывает 2 протона, и образуется 1 молекула воды. Второй атом кислорода идёт на построение ОН-группы (6). Модифицированное вещество R-ОН отделяется от фермента (7).

Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + O2 + NADPH + Н + —> ROH + Н2O + NADP + .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения.
Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
3. Свойства системы микросомального окисления
Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Широкая субстратная специфичность. Изоформы Р450
К настоящему времени описано около 150 генов цитохрома Р450, кодирующих различные изоформы фермента. Каждая из изоформ Р450 имеет много субстратов. Этими субстратами могут быть как эндогенные липофильные вещества, модификация которых входит в путь нормального метаболизма этих соединений, так и гидрофобные ксенобиотики, в том числе лекарства. Определённые изоформы цитохрома Р450 участвуют в метаболизме низкомолекулярных соединений, таких как этанол и ацетон.
Регуляция активности микросомальной системы окисления
Регуляция активности микросомальной системы осуществляется на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ, выведение которых невозможно без участия системы микросомального окисления.
В настоящее время описано более 250 химических соединений, вызывающих индукцию микросомальных ферментов. К числу этих индукторов относят барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды. Несмотря на разнообразие химического строения, все индукторы имеют ряд общих признаков; их относят к числу липофильных соединений, и они служат субстратами для цитохрома Р450.
Б. Конъюгация — вторая фаза обезвреживания веществ
Вторая фаза обезвреживания веществ — реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков (табл. 12-2).
Таблица 12-2. Основные ферменты и метаболиты, участвующие в конъюгации