Методика реакции на пероксидазу – оценка результатов. Бензидиновая проба (проба на пероксидазу) Фермент пероксидаза бывает активным в мясе
Реакция на пероксидазу (бензидиновая проба)
Пероксидаза — фермент, содержащийся в тканях животного и разрушающий перекисные соединения, образующиеся в процессе метаболизма. Сущность реакции заключается в том, что пероксидаза разлагает перекись водорода, и образующийся при этом атомарный кислород быстро окисляет бензидин до парахинодиимида, который с остатками бензидина образует соединение сине-зеленого цвета, переходящего в бурый.
—Постановка реакции. Готовят мясной экстракт 1 :4. В колбу помещают навеску 10—20 г мяса, измельченного ножницами до состояния фарша, добавляют 40-80 мл дистиллированной воды и экстрагируют в течение 15 мин, перемешивая содержимое колбы стеклянной палочкой или используя магнитную мешалку, после чего фильтруют через бумажный фильтр.
—В пробирку вносят 2 мл профильтрованного мясного экстракта, добавляют 5 капель 0,2% спиртового раствора бензидина, содержимое пробирки взбалтывают, после чего добавляют две капли свежеприготовленного 1 % раствора перекиси водорода.
Учет реакции: фильтрат из свежего мяса здоровых животных приобретает зелено-синий цвет, переходящий через несколько минут в бурый. В фильтрате из подозрительного мяса сине- зеленый цвет появляется с большой задержкой и быстро переходит в бурый. Фильтрат несвежего мяса цвета не изменяет.
Определение летучих жирных кислот.
В процессе порчи мяса происходит разложение органических соединений, вследствие чего в нем накапливаются летучие жирные кислоты.

Параллельно при тех же условиях проводят контрольный анализ для определения расхода щелочи на титрование дистиллята с реактивом без мяса.
Количество летучих жирных кислот, в миллиграммах гидроокиси калия в 25 г мяса вычисляют по формуле:
Х=(V- V)· К·5,6. где V— количество 0, 1 н. раствора гидроокиси калия (или гидроокиси натрия), израсходованное на титрование 200 мл дистиллята из мяса, мл; V — количество 0,1 н. раствора гидроокиси калия (или гидроокиси натрия), израсходованное на титрование 200 мл дистиллята контрольного анализа, мл;
К — поправка к титру 0,1 н. раствора гидроокиси калия (или гидроокиси натрия);
5,61 — количество гидроокиси калия, содержащееся в 1 мл 0,1 н. раствора, мг.
За результат испытаний принимают среднее арифметическое двух параллельных определений.
Вычисление проводят с погрешностью не более 0,01 мг гидроокиси калия.
Учет реакции: мясо убойного скота считают свежим, если в 25 г содержится летучих жирных кислот до 4 мг гидроокиси калия (в мясе птицы — до 4,5 мг; в мясе кроликов охлажденном — до 2,25 мг, в замороженном — до 4,5 мг); мясо считают сомнительной свежести, если в 25 г содержится летучих жирных кислот от 4 до 9 мг гидроокиси калия (в мясе птицы — от 4,5 до 9 мг, в мясе кроликов охлажденном — от 2,25 до 9 мг, в замороженном — 4,5—13,5 мг); мясо считают несвежим, если содержание летучих жирных кислот более 9 мг гидроки-си калия в 1 г продукта (у кроликов в замороженном мясе — более 13,5 мг).
Определение наличия аммиака и солей аммония. Сущность реакции заключается в том, что соли аммония и аммиак образуют с реактивом Нес-слера (двойная соль йодистой ртути и йодистого калия, растворенные в гидрате окиси калия) йодид меркураммония желто-бурого цвета.
Постановка реакции. Готовят мясной экстракт 1 : 4. В колбу помещают навеску 5 г мяса, измельченного ножницами до состояния фарша, добавляют 20 мл бидистиллированной воды и энергично перемешивают в течение 15 мин, после чего фильтруют через бумажный фильтр.
В пробирку вносят 1 мл мясного экстракта, добавляют 10 капель реактива Несслера и перемешивают.
Учет реакции: свежее мясо — вытяжка приобретает зеленовато-желтый цвет, остается прозрачной или слегка мутнеет; мясо сомнительной свежести — вытяжка приобретает интенсивно-желтый цвет, наблюдается значительное помутнение, а для замороженного мяса характерно выпадение осадка; несвежее мясо — вытяжка приобретает желто-оранжевый или оранжевый цвет, наблюдается быстрое образование крупных хлопьев, выпадающих в осадок.
Определение кислотного числа жира птицы.
Кислотное число жира — это количество мг NaOH (КОН), необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира.
Кислотное число показывает степень гидролиза жира на свободные жирные кислоты и глицерин.
Подготовка материала к реакции. От каждого образца отбирают не менее 20 г внутренней жировой ткани, измельчают ее ножницами и вытапливают в фарфоровой чашке на водяной бане, затем фильтруют в химический стакан через 4 слоя марли и охлаждают до 20°С.
Постановка реакции : В колбу или химический стаканчик отвешивают около 3—5 г исследуемого топленого жира (с точностью до 0,001 г), ставят в водяную баню и приливают 30-50 мл нейтрализованной смеси спирта с эфиром в соотношении 1:2. К полученному раствору добавляют 3—5 капель I % спиртового раствора фенолфталеина, после чего его быстро титруют 0,1 н. едким натрием до появления, не исчезающего в течение минуты, розового окрашивания. При помутнении смеси в процессе титровании в колбу добавляют 10 мл смеси спирта и эфира, перемешивают до исчезновения мути и заканчивают титрование.
Расчет проводят по формуле:

где Х — кислотное число;
а — количество 0,1 н. едкого натрия, пошедшее на титрование, мл;
5,61 — количество едкого натрия, содержащееся в 1 мл 0,1 н. раствора, мл;
m — навеска жира, г;
К— поправка к титру 0,1 н. раствора NaOH.
Примечание. Смесь спирта с эфиром предварительно нейтрализуют, к ней добавляют несколько капель 1 % раствора фенолфталеина и титруют 0,1 н. едким калием или едким натром до появления слаборозового цвета.
Вычисление производят с погрешностью не более 0,01 мг NaOH.
Учет реакции: жир от охлажденных и замороженных тушек всех видов птицы с кислотным числом до 1 мг NaOH считают свежим; куриный жир от охлажденных тушек с кислотным числом 1,0—2,5 мг NaOH, гусиный — 1,0-2,0 мг NaOH, утиный и индюшиный — 1,0-3,0 мг NaOH, а также жир от мороженых тушек всех видов птицы с кислотным числом 1,0—1,6 мг NaOH считают сомнительной свежести.
Говяжий, свиной, бараний –выс.сорт-1,1, перв.сорт-2,2 мг NaOH
БЕНЗИДИНОВАЯ ПРОБА (проба на пероксидазу)
В пробирку наливают 2 мл фильтрата, 5 капель 0,2%-ного спиртового раствора бензидина и 2 капли 1%-ного раствора перекиси водорода.
Вытяжка из свежего мяса здоровых животных приобретает зелено-синий цвет, переходящий через несколько минут в бурый. В вытяжках из мяса больных, переутомленных и убитых в агонии животных цвет не изменяется, но иногда зелено-синий цвет появляется, с большой задержкой и быстро переходит в бурый.
Реакцию на пероксидазу можно ставить и без приготовления вытяжки: на свежий разрез мяса наносят 2 капли 1%-ного р-ра перекиси водорода и 5 капель 0,2%-ного р-ра бензидина. Появление сине-зелёного пятна с последующим переходом в бурое расценивают как положительную реакцию, отсутствие цветного пятна считают за отрицательную реакцию.
ФОРМОЛЬНАЯ РЕАКЦИЯ
Мясо животных, убитых после длительной агонии или тяжёлого патологического состояния, можно распознать по показателям формольной реакции..
Пробу мяса освобождают от жира и соединительной ткани. Навеску в 10 г помещают в ступку, тщательно измельчают ножницами, приливают 10 мл физ. р-ра и 10 капель 0,1 н едкого натрия. Мясо растирают пестиком. Полученную кашицу переносят стеклянной палочкой в колбу и нагревают до кипения для осаждения белков. Колбу охлаждают водопроводной водой, после чего содержимое её нейтрализуют добавлением 5 капель 5%-ного р-ра щавелевой кислоты и пропускают в пробирку через фильтровальную бумагу. Мутную вытяжку фильтруют вторично или центрифугируют.
Ход реакции. В пробирку наливают 2 мл вытяжки и добавляют 1 мл нейтрального формалина.
Вытяжка из мяса животного, убитого в агонии, тяжело больного или разделанного после падежа, превращается в плотный сгусток; в вытяжке из мяса больного животного выпадают хлопья, вытяжка из мяса здорового животного остается жидкой и прозрачной, иногда появляется слабое помутнение.
Формалин предварительно нейтрализуют 0,1 н едким натрием по индикатору, состоящему из равной смеси 0,2%-ных водных растворов нейтральрота и метиленового голубого до перехода цвета из фиолетового в зеленый.
Санитарная оценка мяса
Проводится по результатам исследования и заносится в рабочую тетрадь.
При выявлении признаков, свидетельствующих о том, что животное убито во время агонии (гипостазы, плохое обескровливание, отсутствие реакции на месте зареза), туши и органы подлежат технической утилизации.
В мясе от здорового животного отсутствуют патогенные микроорганизмы, рН в пределах 5,7-6,2, реакция на пероксидазу положительная.
Подозрительным в происхождении от больного или вынужденно убитого животного считается мясо при рН 6,3 и выше и отрицательной реакции на пероксидазу.
ВИДОВАЯ ПРИНАДЛЕЖНОСТЬ МЯСА
Попытка выдать мясо одного вида животного за мясо другого вида животного, как правило, более ценного называется видовой фальсификацией и может иметь место на рынках в торговой сети и учреждениях общественного питания. Поэтому ветеринарный врач обязан уметь определять видовую принадлежность мяса. Обычно при видовой фальсификации используют туши животных, схожих по размеру, форме и другим показателям. Так конину обычно пытаются выдать за говядину и наоборот (в некоторых странах где конина ценится выше), туши крупных собак выдают за бараньи, кошек пытаются выдать за кроликов и нутрий. Для определения видовой принадлежности мяса используют объективные и субъективные методы.
Субъективные методы определения видовой принадлежности мяса. К субъективным методам относят такие как конфигурация, морфологические и органолептические показатели мяса и др.
Органолептические показатели
Определение по цвету мяса
Цвет мяса и структура мышечной ткани зависят от возраста, пола, упитанности животных и других причин.
Мясо крупного рогатого скота может быть от светло красного до темно красного, на поперечном разрезе крупнозернистое.
Мясо лошадей темно красного
После варки мясо свиней и телят приобретает белый или светло-серый цвет, мясо крупного рогатого скота, овец и лошадей — темно-серый цвет.
Методика реакции на пероксидазу – оценка результатов. Бензидиновая проба (проба на пероксидазу) Фермент пероксидаза бывает активным в мясе
Принцип реакции на пероксидазу по методу Грахама-Кнолля. Клеточные пероксидазы разлагают перекись водорода; высвобождаемый при этом кислород окисляет бензидин. Последний представляется в виде желто-коричневого осадка на уровне пероксидазополо-жительной зернистости.
Реагенты для реакции на пероксидазу:
1) Закрепитель: винный спирт 96° (9 частей) +40% формалин (1 часть).
2) Спиртный раствор бензидина с перекисью водорода, содержащий: несколько кристаллов бензидина, 10 мл спирта 40° и 0,02 мл 3% перекиси водорода.
После растворения бензидина в спирте профильтровать раствор и добавить перекись водорода с помощью градуированной до 0,02 мл пипетки для гемоглобина.
3) 10% разбавленный раствор Гимза.
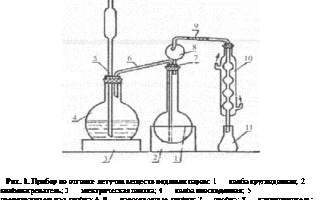
Техника реакции на пероксидаху
Закрепление мазков в смеси спирт-формалин, 30 сек.; промывание дистилированной водой; окраска раствором бензидина и перекиси водорода — 5 мин; промывание дистилированной водой; контрастная окраска разведенным раствором Гимза — 25 мин.; в заключении промывание проточной водой.
Рекомендуется работать лишь со свежеприготовленными мазками.
Результаты реакции на пероксидаху. Желто-коричневая зернистость говорит о наличии активности клеточных пероксидаз. Реакция положительная в клетках нормального гранулоцитного ряда, начиная с промиелоцита. Миелобласт содержит пероксидазы на более развитой стадии, приближающейся к промиелоциту.
Лимфоидные клетки отрицательные. Реакция моноцитов отрицательная или слабо положительная.
Практическое значение реакции на пероксидаху. Дифференциация цитологического вида острой лейкемии: в лимфобластах отрицательная, в то время как в миелобластах активность ферментов разной интенсивности. Тела Ауера перокси дазоположительные. Значимость метода ограничена: положительная реакция составляет ценное сведение, в то время как отрицательная — не убедительна; результат следует сопоставить с другими цитохимическими исследованиями.
При отдельных тяжелых инфекциях, хронических миелопролиферациях, равно как и в процессе некоторых миелодиспластических сдвигов (предлейкемическое состояние) в зрелых нейтрофильных гранулоцитах отмечаются частично или полностью пероксидазоотрицательные зоны. Отмеченные изменения наряду с подобным поведением пероксидазы представляют ценность для раннего диагностирования предлейкемического состояния.
Проба на пероксидазу
Метод основан на способности фермента пероксидазы принимать участие в процессах окисления за счет кислорода пероксида водорода. Присутствие пероксидазы устанавливают, используя реакции с гваяколом, бензидином, амидопирином (пирамидоном). При температуре 80 °C пероксидаза инактивируется. Следовательно, если в исследуемом изделии пероксидаза обнаруживается, тепловая обработка считается недостаточной.
Аппаратура, материалы, реактивы. Весы лабораторные; пробирки химические диаметром 15 мм; пробки корковые; штатив для пробирок; ступка фарфоровая диаметром 7 – 9 см; капельницы; часы песочные на 1, 2 мин.; воронки стеклянные диаметром 4 – 5 см; пипетки вместимостью 1 и 20 см 3 ; колбы конические вместимостью 50 и 100 см 3 ; бумага фильтровальная; вата; гваякол, спиртовой раствор с массовой долей 1% (1 г гваякола растворяют этиловым спиртом в мерной колбе на 100 см 3 ); бензидин, спиртовой раствор с массовой долей 0,02% (20 мг бензидина растворяют в 100 см 3 этилового спирта); амидопирин, спиртовой раствор с массовой долей 2% (2 г амидопирина растворяют в 98 см 3 этилового спирта); спирт этиловый; пероксид водорода (30 – 35%), раствор с массовой долей 10%; кислота уксусная ледяная; ацетат натрия безводный; вода дистиллированная.
Проведение испытания. Окислительно-восстановительные свойства пероксидазы проявляются в строго определенном интервале pH. Наиболее интенсивная окраска наблюдается в интервале значений pH от 4,4 до 6,9; менее интенсивная при pH 3,4 и выше; не проявляется при pH выше 10,4.
При анализе используют ацетатный буферный раствор с pH 4,9.
Измельченную навеску, взятую из внутренней части жареного изделия в количестве 10 г и взвешенную с точностью до 0,01 г, растирают в ступке с 20 см 3 дистиллированной воды и фильтруют через бумажный фильтр или слой ваты в коническую колбу. Затем отбирают в пробирку 0,5 см 3 фильтрата, добавляют 0,5 см 3 ацетатного буфера, 0,5 см 3 спиртового раствора гваякола, 0,25 см 3 свежеприготовленного раствора пероксида водорода и встряхивают. При достаточной термической обработке мясного изделия раствор остается бесцветным, при недостаточной, в зависимости от количества сохраненной пероксидазы, окраска может быть от светло-голубой до темно-синей и проявляется в течение 1 мин.
При использовании спиртового раствора бензидина или спиртового раствора амидопирина в пробирку отбирают 1 см 3 фильтрата, добавляют 1 см 3 одного из указанных растворов, а также 0,5 см 3 раствора пероксида водорода и встряхивают. При наличии пероксидазы в течение 1 мин. появляется соответственно сине-зеленое или сине-фиолетовое окрашивание. При достаточной тепловой обработке изменения цвета не происходит.
Учитывая, что в мясе больных животных и в несвежем мясе происходит инактивация фермента пероксидазы, для окончательного суждения о качестве тепловой обработки кулинарных изделий необходимо проверить наличие пероксидазы в мясном полуфабрикате. При отсутствии пероксидазы в полуфабрикате достаточность тепловой обработки определяют пробой на фосфатазу.
Проба на фосфатазу
Качественная реакция. Метод основан на способности фермента фосфатазы расщеплять бариевую соль паранитрофенилфосфата при температуре 38 °C, освобождая паранитрофенол, который окрашивает среду в желтый цвет.
Аппаратура, материалы, реактивы. Весы лабораторные; плитка электрическая; баня водяная; ступка фарфоровая диаметром 7-9 см; цилиндр вместимостью 1 см 3 ; воронка делительная вместимостью 250 см 3 ; пробки корковые; капельница; воронки стеклянные диаметром 4-5 см; марля; бумага фильтровальная; вата стеклянная; бариевая соль паранитрофосфата, насыщенный раствор; гидроксид натрия, раствор массовой концентрации 400 г/дм 3 (Д = 1,43 г/куб. см); хлорид магния, раствор массовой концентрации 5 г/ дм 3 ; ацетатный буфер pH 5,4; вода дистиллированная.
Проведение испытания. Измельченную навеску, взятую из внутренней части изделия в количестве 20 г и взвешенную с точностью до 0,01 г, переносят в ступку и растирают, добавляя постепенно 50 см 3 дистиллированной воды. Полученную взвесь процеживают через двойной слой марли, а оставшуюся в марле навеску отжимают, затем вытяжку фильтруют через сухой складчатый фильтр и делят пополам. Одну часть (фильтрат 1) исследуют непосредственно, другую (фильтрат 2) переносят в коническую колбу, доводят до кипения и снова фильтруют – эта часть фильтрата является контрольной.
Для проверки активности фосфатазы в пробирку отмеривают 1 см 3 фильтрата 1, прибавляют 2 капли раствора хлорида магния массовой концентрации 5 г/дм 3 , 2 капли ацетатного буфера (pH 5,4) и 0,5 см 3 раствора бариевой соли паранитрофенилфосфата.
Для контроля во вторую пробирку отмеривают 1 см 3 фильтрата 2 и добавляют те же реактивы, что и в первую. Обе пробирки помещают на 1 ч в водяную баню или термостат при температуре 37-38 °C. Затем в обе пробирки добавляют по капле раствора гидроксида натра.
При достаточной тепловой обработке кулинарного изделия окраска в обеих пробирках не меняется. При недостаточной тепловой обработке раствор желтеет.
Определение остаточной активности кислой фосфатазы (количественное определение). Метод основан на фотометрическом определении в продукте интенсивности развивающейся окраски, зависящей от остаточной активности кислой фосфатазы, выраженной массовой долей фенола.
Аппаратура, материалы, реактивы. Весы лабораторные; потенциометр с погрешностью измерения ± 0,06 pH; фотоэлектроколориметр или спектрофотометр для измерения в видимой области спектра; ультратермостат или водяная баня; воронки; колбы мерные вместимостью 500 и 1000 см 3 ; пипетки градуированные на 1; 5; 10 см 3 ; палочки стеклянные; пробирки; бумага фильтровальная; груша резиновая; кислота лимонная; цитрат натрия 5-водный; динатриевая соль фенилфосфорной кислоты, раствор массовой концентрации 2 г/дм 3 , свежеприготовленный; кислота трихлоруксусная, кристаллическая, растворы массовой концентрации 50 и 200 г/дм 3 ; гидроксид натрия, раствор C(NaOH) = 0,5 моль/дм 3 ; вода дистиллированная; фенол; толуол; вольфрамат натрия; сульфат лития 1-водный; кислота ортофосфорная плотностью 1,72 г/см 3 ; кислота соляная плотностью 1,19 г/см 3 ; бром.
Подготовка к испытанию. Ацетатный буфер: в мерной колбе вместимостью 1000 см 3 в дистиллированной воде растворяют 13,88 г цитрата натрия и 0,588 г лимонной кислоты, доливают водой до метки и перемешивают, pH буфера 6,5. Затем добавляют 1 см 3 толуола. Раствор хранят в холодильнике при температуре 4 ±1°C не более 12 сут.
Реактив Фолина: 100 г вольфрамата натрия и 25 г молибдата натрия растворяют в 700 см 3 дистиллированной воды. К раствору добавляют 50 см 3 ортофосфорной кислоты и 100 см 3 соляной кислоты. Смесь осторожно кипятят в течение 10 ч в колбе вместимостью 2000 см 3 с обратным холодильником, после чего охлаждают и добавляют 150 г сульфата лития, 50 см 3 воды и несколько капель брома. Остаток брома отгоняют кипячением смеси без холодильника в вытяжном шкафу, охлаждают, переносят в мерную колбу вместимостью 1000 см 3 , доводят объем дистиллированной водой до метки, перемешивают и фильтруют. Реактив должен быть золотисто-желтого цвета без зеленого оттенка; его хранят в склянке с притертой пробкой в темном месте не более 6 мес.
Стандартный раствор: 2 г фенола (взвешивают с точностью до 0,001 г) растворяют в воде в мерной колбе вместимостью 1000 см 3 , доводят объем до метки и перемешивают. Отбирают пипеткой с помощью резиновой груши 5 см 3 раствора в колбу вместимостью 500 см 3 , добавляют около 300 см 3 дистиллированной воды, вносят 25 г кристаллической трихлоруксусной кислоты. После растворения содержимое колбы доводят до метки дистиллированной водой и перемешивают. Полученный раствор содержит 20 мкг фенола в 1 см 3 .
Построение градуировочного графика. В пробирки вносят следующие объемы стандартного раствора: 0; 0,25; 0,5; 1,0; 1,5; 2,0 см 3 , что соответствует массе фенола: 0; 5; 10; 20; 30; 40 мкг. Доводят объем каждой пробирки до 2,5 см 3 , добавляя соответствующий объем раствора трихлоруксусной кислоты массовой концентрации 50 г/дм 3 (2,5; 2,25; 2,0; 1,5; 1,0; 0,5 см 3 ), и перемешивают. В каждую пробирку добавляют 5 см 3 раствора гидроксида натрия, перемешивают, выдерживают 10 мин., добавляют 1,5 см 3 реактива Фолина, разведенного дистиллированной водой в соотношении 1:2, и перемешивают.
Через 30 мин. измеряют оптическую плотность растворов по отношению к раствору трихлоруксусной кислоты массовой концентрации 50 г/дм 3 на фотоэлектроколориметре с применением светофильтра с длиной волны 600 ± 10 нм в кювете с расстоянием между рабочими гранями 10 мм или спектрофотометра при длине волны 600 нм в кювете аналогичного размера.
По полученным средним данным по трем стандартным растворам на миллиметровой бумаге размером 20×20 см строят градуировочный график. На оси абсцисс откладывают значение массовой доли фенола (микрограмм в 9 см 3 окрашенного раствора); на оси ординат – значение соответствующей оптической плотности (Д). Градуировочный график должен проходить через начало координат.
Проведение испытания. От объединенной пробы, подготовленной к испытанию, берут 2 навески массой по 1 г (с точностью до 0,001 г) и переносят в две пробирки (контрольную и опытную).
В пробирки вносят по 10 см 3 ацетатного буфера pH 6,5, тщательно перемешивают стеклянной палочкой и настаивают в течение 20 мин. при температуре 20 °C, периодически перемешивая.
В контрольную пробирку добавляют 5 см 3 (200 г/дм 3 ) раствора трихлоруксусной кислоты, перемешивают и добавляют 5 см 3 (2 г/дм 3 ) раствора динатриевой соли фенилфосфорной кислоты, выдерживают 10 мин и фильтруют.
В опытную пробирку добавляют 5 см 3 (2 г/дм 3 ) раствора динатриевой соли фенилфосфорной кислоты и помещают в термостат при температуре 39 ± 1 °C на 1 ч, затем добавляют 5 см 3 200 г/дм 3 раствора трихлоруксусной кислоты, выдерживают 10 мин. и фильтруют.
Для проведения цветной реакции из контрольной и опытной пробирок отбирают по 2,5 см 3 безбелкового фильтрата. Цветную реакцию проводят по методу, описанному выше.
Массу фенола в навеске определяют по градуировочному графику.
Обработка результатов. Массовую долю фенола (X, %) вычисляют по формуле:
 (6.2)
(6.2)
m1 – масса фенола в опытной пробирке, найденная по
градуировочному графику, мкг;
m2 – масса фенола в контрольной пробирке, найденная по
градуировочному графику, мкг;
m – масса анализируемой пробы, г;
10 – коэффициент пересчета;
2,5 – объем фильтрата, отобранный для цветной реакции,
Вычисление проводят до 0,0001.
За окончательный результат испытания принимают среднее арифметическое результатов двух параллельных определений, допустимое расхождение между которыми при P = 0,95 не должно превышать 10% по отношению к среднему арифметическому.
Окончательный результат определяют до 0,001.
Анализ результатов работы:сделать выводы о влиянии сульфитации на активность окислительно-восстановительных процессов, сравнить активность каталазы в разных образцах.
Контрольные вопросы
1. Что такое ферменты?
2. Какими свойствами обладают ферменты?
3. Какие факторы влияют на активность ферментов?
4. Какой принцип положен в основу классификации ферментов? Сколько классов ферментов включает их классификация?
5. Какова роль окислительно-восстановительных ферментов?
6. Каковы строение и механизм действия дегидрогеназ?
7. Каковы строение и механизм действия полифенолоксидазы?
8. Каковы строение и механизм действия аскорбатоксидазы?
9. Каковы строение и механизм действия липоксигеназы?
10. Каковы строение и механизм действия пероксидазы?
11. Каковы строение и механизм действия каталазы?
12. Какова роль каталазы в пищевых технологиях и в процессах жизнедеятельности клетки?
13. Как определить активность каталазы?
Задания к теме
1. Каким свойством обладают ферменты?
а) Специфичность действия.
б) Способность сдвигать равновесие в системе.
г) Универсальность действия.
2. Какая из аминокислот наиболее часто входит в активный центр фермента?
а)Серин, б)Глицин, в)Валин, г)Метионин.
3. Для чего служит каталитический центр фермента?
а) Присоединение кофермента.
б) Превращение субстрата.
в) Связывание эффекторов.
г) Присоединение и ориентация субстрата.
4. Какой класс ферментов ускоряет реакции распада с участием воды?
а) Оксидоредуктазы, б) Трансферазы, в) Гидролазы, г) Лиазы.
5. Какие реакции ускоряют ферменты класса лигаз?
а) Негидролитический распад органических молекул.
б) Реакции переноса функциональных групп.
в) Реакции синтеза.
г) Окислительно-восстановительные реакции.
6. Что такое кофермент?
а) Фермент, связанный с субстратом.
б) Небелковое, легко отделяющееся от фермента вещество, участвующее в катализе.
в) Неактивный предшественник фермента.
г) Активатор фермента.
7. Для чего служит контактный участок?
а) Присоединение кофермента.
б) Превращение субстрата.
в) Связывание эффекторов.
г) Присоединение и ориентация субстрата.
8. Что такое изоэнзимы?
а) Ферменты, катализирующие реакции изомеризации.
б) Денатурированные энзимы.
в) Ферменты, имеющие разную четвертичную структуру, но катализирующие одну и ту же реакцию.
г) Энзимы, имеющие одинаковую брутто-формулу, но разное строение.
9. Какие реакции ускоряют ферменты класса лиаз?
а) Негидролитический распад и синтез с образованием двойных связей.
б) Реакции переноса функциональных групп.
в) Реакции изомеризации.
г) Окислительно-восстановительные реакции.
10. Что такое простетическая группа?
а) Фермент, связанный с субстратом.
б) Небелковая часть молекулы фермента, легко отделяющаяся от него.
в) Небелковая часть молекулы, прочно связанная с апоферментом.
г) Фрагмент одного из витаминов.
Проверь себя
1. Совокупность каталитического и субстратного центров фермента называется:
а) апофермент, б) активный центр фермента, в) аллостерически участок.
2. Небелковая часть сложного фермента, ответственная за катализ называется:
а) кофермент, б) кофактор, в) апофермет.
3. Клеточные ферменты, локализованные в цитоплазме, проявляют максимальную активность при рН, близком к:
а) 7, б) 2-3, в) 4-5, г) 9-10.
4. В состав кофермента входит витамин:
5. Ферменты, катализирующие синтез биологических молекул с участием АТФ относятся к классу:
а) трансфераз, б) лигаз, в) гидролаз, г) лиаз, д) изомераз.