Образование эндотоксинов. Бактериальные эндотоксины. Результаты и интерпретация
Образование эндотоксинов. Бактериальные эндотоксины. Результаты и интерпретация

Наиболее комментируемые материалы на форуме
Последние комментарии на форуме
Бактериальные эндотоксины.
Способы удаления бактериальных эндотоксинов из биологических образцов.
В широком смысле под эндотоксинами понимают бактериальные токсические вещества, которые являются структурными компонентами бактерий. Частным и наиболее упоминаемым эндотоксином являются липополисахариды (ЛПС). Липополисахариды – структурные компоненты мембран грам-негативных бактерий, поддерживающие стабильность мембраны. На одну клетку Escherichia coli приходится около двух миллионов молекул ЛПС. Несмотря на то, что эндотоксины достаточно прочно связаны с мембраной клеток, в процессе деления и смерти бактериальных клеток происходит высвобождение бактериальных эндотоксинов. Присутствие бактериальных эндотоксинов в препаратах, в особенности применяемых для внутривенного введения, представляет собой огромную проблему. Хотя сами по себе эндотоксины не являются токсическими веществами, их попадание в организм активирует иммунную систему – в основном процесс идет через активацию моноцитов и макрофагов – что приводит к высвобождению целого ряда противовоспалительных медиаторов, таких как фактор некроза опухоли (tumor necrosis factor – TNF), интерлейкины (особенно IL-6 и IL-1) и других агентов. Развитие каскадной противовоспалительной реакцией, сопровождающейся повышением температуры и лихорадкой (так называемый, эндотоксический шок), может привести к летальному исходу.
По сравнению с белками, бактериальные эндотоксины очень стабильны. Их стабильность сохраняется при высоких значениях температур и в широком диапазоне рН.
Работы, описывающие токсический эффект после внутривенного введения растворов, приготовленных из бактериальных культур и не содержащих микроорганизмов, начали публиковать с конца 19-ого века. И количество подобных работ постоянно увеличивалось.
В 1912 году Hort и Penfold стали использовать термин “пирогенный” (pyrogenic) для обозначения растворов, вызывающих лихорадочное состояние. В 1945 году Westphal опубликовал работу, в которой он описывал полисахаридный комплекс, обнаруженный во внешнем слое бактериальной стенки и обладающий пирогенным эффектом.
В последующие годы Westphal опубликовал еще несколько работ, где он продолжал изучать липосахариды из различных энтеробактерий. В последующие годы молекулярная организация эндотоксинов и механизм их воздействия на организм продолжали изучаться.
Бактериальные эндотоксины, также называемые полисахаридами (ЛПС), являются главным компонентом внешней мембраны грам-негативных бактерий (см. рис. 1).
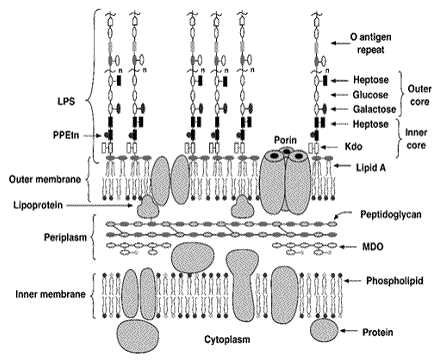
Рисунок 1: Молекулярная модель внутренней и внешней мембран из E. coli K-12
Формы: овалы и прямоугольники представляют сахарные остатки, кружки – полярный рабочие группы различных липидов.
Сокращения: PPEtn (ethanolamine pyrophosphate); LPS (lipopolysaccharide); Kdo (2-keto- 3-deoxyoctonic acid).
Бактериальные эндотоксины состоят из гидрофильного полисахаридного остатка, который соединен ковалентной связью с гидрофобным липидным остатком (липид А) (см. рис. 2).
Липосахариды большинства видов бактерий состоят из трех основных блоков:
– блок О-антигена (O-antigen region),
– олигосахарид сердцевины (core oligosaccharide),
– липид А (lipid A).
О-антиген в основном состоит из последовательности одинаковых олигосахаридов (от трех до восьми моносахаридов каждый), определяющих видовую специфичность и серологическую особенность соответствующей бактерии.
Олигосахарид сердцевины имеет консервативную структуру с внутренней областью 3-дезокси-D-манно-2- октулосоновой кислота (KDO) – гептоза и внешней области состоящей из гексоз. Так, например, среди видов E.coli известно пять разных типов сердцевинной области. Липид А является самой консервативной частью эндотоксина и отвечает за большинство биологических свойств эндотоксина, в том числе, за его биологическую токсичность. Бактериальные штаммы, в составе мембраны которых отсутствовал бы липид А или эндотоксин, не известны современной науке.
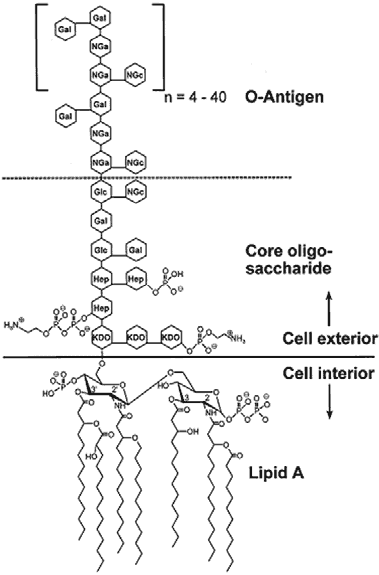
Рисунок 2: Химическая структура эндотоксина из E. coli
(Hep) L-glycerol-D-manno-heptose; (Gal) galactose; (Glc) glucose; (KDO) 2-keto-3-deoxyoctonic acid; (NGa) N-acetylgalactosamine; (NGc) N-acetyl-glucosamine.
Молекулярная масса мономера эндотоксина обычно составляет от 10 до 70 кДа. Но встречаются и отдельные исключения: 2.5 кДа с коротким О-антигеном до 70 кДа с очень длинным О-антигеном. Клетки “теряют” эндотоксины в большом количестве во время своей гибели, а также в процессе роста и деления. Эндотоксины устойчивы к высоким температурам и не разрушаются при стандартных режимах автоклавирования. Эндотоксины можно разрушить только при использовании следующих режимов: 250 °С в течение 30 минут или 180 °С в течение более 3 часов. Применение кислот и щелочей с концентрацией не менее 0.1 М также может привести к разрушению эндотоксинов.
Методы удаления эндотоксинов
Существует целый ряд методов, которые применяют для удаления бактериальных эндотоксинов: ионообменная хроматография, аффинные сорбенты, гель-фильтрация, ультрафильтрация, центрифугирование в градиенте сахарозы, использование системы двухфазного разделения.
Способ удаления определяется масштабами и экономической целесообразностью. Для удаления эндотоксинов из больших объемов обычно используют ультрафильтрацию и ионообменную хроматографию. Ультрафильтрация очень эффективна для удаления эндотоксинов из воды и водных растворов, но совершенно не годится в случаях очистки от эндотоксинов растворов, содержащих белки или нуклеиновые кислоты. Те же недостатки ультрафильтрации относятся и к ионообменной хроматографии. Использование аффинных сорбентов, как правило, иммобилизованных на агарозе, сефарозе, акриламиде и других носителях, является, пожалуй, самым эффективным способом удаления бактериальных эндотоксинов. Основные минусы такого подхода: 1. длительность процесса удаления (необходимо многократно пропускать пробу через колонку, скорость протока при этом не может быть большой, т.к. это приводит к деформации сорбента), 2. разбавление пробы в процессе очистки может быть от 10 до 100-кратной, 3. стоимость аффинного сорбента может быть очень большой.
Двухфазная система разделения является самым дешевым и самым эффективным способом удаления эндотоксинов. Основной принцип этого метода – образование двухфазной мицеллярной системы за счет добавляемого в водный раствор мицеллообразующего полимера. Бактериальный эндотоксин захватывается образующимися мицеллами из водной гидрофильной части и при разделении фаз остается в гидрофобной среде (см. рис. 3).
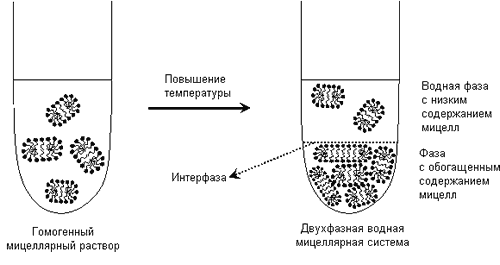
Рисунок 3: Схема двухфазного мицеллярного разделения, вызванного повышением температуры.
Мицеллы могут присутствовать и в водной фазе, но их размер значительно меньше, чем в нижней гидрофобной части.
Использование трех циклов обработки двухфазной системой позволяет снизить уровень эндотоксинов во всех рекомбинантных белках, получаемых из E. coli, более чем на 99%. При этом биологическая активность и свойства самих белков не претерпевают изменений.
Минус двухфазной системы – в водной фазе после разделения всегда остается некоторое количество добавляемого мицеллообразующего полимера. Некоторые исследователи считают, что примеси этого полимера оказывают негативное влияние при дальнейшем использовании очищенных таким образом препаратов. Другие исследователи опровергают негативное такое негативное влияние. Наш опыт использования препаратов, очищенных от бактериальных эндотоксинов при помощи двухфазной мицеллярной системы, как в системе in vitro, так и in vivo, не показал никаких негативных эффектов ни на клетки, ни на животных, в которые вводили очищенные препараты.
По-видимому, работа с такой системой требует некоторых навыков и их недостаток может проявляться в последующих результатах.
Определение эндотоксинов
Для определения эндотоксинов стандартно применяют LAL тест (LAL: Limulus Amebocyte Lysate). С семидесятых годов этот тест вытеснил применявший ранее так называемый “пирогенный тест”, когда испытуемый препарат вводили кроликам. Кролики очень чувствительны к эндотоксинам и их реакция на вводимые препараты долгое время служила индикатором пирогенности.
В настоящее время стал применяться также EAA тест (EAA: Endotoxin Activity Assay). Этот тест разработан компанией Spectral Diagnostics Inc. (www.spectraldx.com) и позволяет выявлять уровень эндотоксинов в крови.
По международной классификации концентрацию эндотоксинов обозначают в EU (endotoxin units): EU/мл или EU/мг. Одна единица (1 EU) приблизительно соответствует 100 пг эндотоксина. Одна бактериальная грам-негативная клетка содержит приблизительно 10-15г или 1 фг эндотоксина, таким образом, 1 EU производят 105 бактерий. 1 мл ночной культуры E. coli содержит от 5·108 до 109 клеток, что соответствует до 10’000 EU на 1 мл культуры.
Максимально допустимый уровень эндотоксина при внутривенном введении – 5 EU на кг тела в течение часа.
Сравнительная характеристика бактериальных экзотоксинов и эндотоксинов;
Характеристика эндотоксинов.
Эндотоксины
Различные клинические формы инфекционных заболеваний, вызываемые разными патогенными штаммами одного вида бактерий, связаны с их способностью продуцировать различные типы токсинов.
Различные штаммы S. aureus могут продуцировать один из 7 типов энтеротоксинов, которые вызывают энтеротоксемию. Другие штаммы S. aureus могут продуцировать два типа эксфолиатинов. Причиной синдрома стафилококкового токсического шока является «токсин синдрома стафилококкового токсического шока».
У Е. coli обнаружено 8 типов токсинов, при этом прослеживается закономерность:
– штаммы, продуцирующие LT–энтеротоксин, вызывают холероподобную диарею,
– штаммы, продуцирующие ST–энтеротоксин, вызывают более тяжелую диарею,
– штаммы, продуцирующие шигеллоподобный токсин, вызывают дизентерия-подобное заболевание.
5. Клиническая картина заболеваний не во всех случаях зависит от типа токсина, который продуцирует конкретный штамм. Дифтерийный токсин обнаружен у С. diphtheriae, С. ulcerans, С. pseudotuberculosis, шигеллезный — у S. dysenteriae, S. flexneri, E. coli, V. cholerae, V. parahaemolyticus, C. jejuni, НАГ–вибрионов. Шигеллоподобный токсин обнаружен у многих штаммов холерного вибриона, хотя они в основном вызывают холеру.
1. Липополисахаридные комплексы КС, главным образом Грам- бактерий, освобождаются только после гибели бактерий. Существенной частью эндотоксина считается липид А, однако токсические свойства эндотоксина определяются всей молекулой ЛПС, поскольку один липид А менее токсичен, чем молекула ЛПС в целом. Образование эндотоксинов присуще энтеробактериям, бруцеллам, риккетсиям, чумной палочке.
2. Менее токсичны, чем экзотоксины.
3. Неспецифичны: в сыворотке крови переболевших людей и при иммунизации животных различными ЛПС обнаруживаются антитела низкой специфичности и наблюдается сходная клиническая картина.
4. Действуют быстро.
5. Являются гаптенами или слабыми антигенами, обладают слабой иммуногенностью. Сыворотка животного, иммунизированного эндотоксином, обладает слабой антитоксической активностью и не нейтрализует эндотоксин.
6. Термостабильны, не инактивируются температурой, при нагревании активность эндотоксина повышается.
7. Не инактивируются химически (не переходят в анатоксины при обработке формалином).
Сравнительная характеристика бактериальных токсинов приведена в табл. 42.
Существуют физиологические механизмы поступления очень небольших (порядка нанограммов) количеств эндотоксина в кровоток. Всасываясь в толстом кишечнике и поступая в печень, большая часть эндотоксина в норме элиминируется фагоцитами, но часть проникает в системный кровоток, вызывая ряд физиологических эффектов.
При поступлении в кровь малых доз эндотоксина наблюдается:
– стимуляция фагоцитоза, повышение резистентности организма;
– увеличение температуры тела в результате действия токсина на клетки крови (гранулоциты, моноциты), из которых выделяются эндогенные пирогены (ИЛ1), действующие на гипоталамические терморегуляционные центры;
– активация комплемента по альтернативному пути;
– поликлональная стимуляция и пролиферация В–лимфоцитов, синтез Ig M;
– реализация противоопухолевого иммунитета (секреция ФНО);
– активация противовирусной защиты.
При поступлении в кровь больших доз эндотоксина развиваетсяинфекционно-токсический шок (ИТШ) — выраженная системная реакция организма в результате воздействия эндотоксинов и бактериальных продуктов на клеточные мембраны, компоненты свертывания крови и комплемент. Грам- флора чаще вызывает ИТШ (в 70% случаев), он протекает тяжелее, летальность выше (60–90% при Грам- этиологии и 30–40% при Грам+).
ИТШ развивается на фоне нарастания интоксикации: у больного наблюдается слабость, одышка, тахикардия, гипотония, озноб, за которым следует резкий подъем температуры, часто наблюдается тошнота, рвота, диарея, состояние прострации. ИТШ проявляется нарушением микроциркуляции, внутрисосудистым свертыванием крови, некрозами тканей. Он часто завершается сепсисом с летальным исходом.
Симптомы ИТШ могут появляться или усиливаться после применения бактерицидных антибиотиков, что связано с интенсивным бактериолизом и выбросом эндотоксинов (реакция обострения Герксгеймера-Яриша-Лукашевича или реакция бактериолиза). Это подтверждает участие в патогенезе шока продуктов распада бактериальных клеток. Поэтому при высоком риске участия Грам- бактерий в качестве этиологического фактора и при угрозе развития ИТШ, предпочтение должно бактериостатическим антибиотикам.
Эндотоксиновый шок наиболее демонстративен при менингококковой инфекции. Среди представителей нормальной микрофлоры основным носителем эндотоксина являются Грам- микроорганизмы семейства Bacteroidaceae. Данная реакция встречается также при инфекциях, протекающих без явлений шока. Напр., при лечении вторичного свежего сифилиса после первых инъекций пенициллина у больных отмечается повышение температуры тела и усиление воспаления в области сифилид — розеолы приобретают более насыщенный розово-красный цвет. Это связано с интенсивным лизисом бледной спирохеты и усилением иммунных реакций на продукты распада.
Патогенетические мехнизмы ИТШ.
1. Активация комплемента способствует повышению количества серотонина и кининов в крови, в результате наблюдается гипотония.Фактор комплемента С2 обладает кининовой активностью и увеличивает проницаемость сосудов. Фрагменты комплемента С3а, С4а и С5а (анафилотоксины) стимулируют высвобождение гистамина из тучных клеток и базофилов, вызывают сокращение гладких мышц и увеличивают проницаемость сосудов. Фрагмент С5а, взаимодействуя со специфическими высокоаффинными рецепторами тромбоцитов, вызывает агрегацию клеток, а с рецепторамигранулоцитов — хемотаксис, усиление прилипания и активацию клеток. Активированные нейтрофилы высвобождают метаболиты арахидоновой кислоты, бескислородные радикалы и лизосомальные ферменты, индуцирующие воспаление тканей и увеличивающие проницаемость капилляров.
2. Выделение эндогенных цитокинов, мишенями для которых являются лейкоциты, эндотелий и сердце. Медиаторы воспаления и эндогенные цитокины снижают тонус сосудов, кровь скапливается в капиллярах, белки плазмы пропотевают в интерстициальную жидкость.
3. Образование нитратов. При воспалительной реакции в организме ключевую роль в образовании нитратов играют макрофаги. Фермент макрофагов NO–синтаза превращает аргинин в NO, из которого затем могут образовываться нитриты и нитраты. При активации макрофаги усиливают синтез NО–синтазы. Главная функция NO состоит в обеспечении цитотоксического действия макрофагов. Выделяясь из макрофагов, NO быстро проникает в бактерии и клетка погибает. Кроме того, NO снижает активность пограничных воспалительных клеток и улучшает местное кровообращение.
NO связывается с кислородом и образует высокотоксичные пироксинитриты, повреждающие белки и липиды клеточных мембран, сосудистый эндотелий, вызывающие ишемические и язвенные поражения органов.
4. Переключение в пораженных областях аэробных энергетических путей на анаэробный гликолиз значительно увеличивает потребление глюкозы при одновременном уменьшении выхода АТФ.
5. Снижение синтеза белков, особенно имеющих короткое время полужизни, напр., факторов свертывания. Таким образом, увеличивается время свертывания крови.
6. Начинается выход калия из клеток. Метаболический ацидоз возникает в результате увеличенной продукции лактата, пирувата, a–кетоглутарата и кетоновых тел. Ацидоз частично компенсируется усиленным дыханием.
7. Повышение концентрации Н+ в плазме, в результате чего снижается чувствительность прекапиллярных сфинктеров, возникают отеки, повышается выброс катехоламинов, активируется свертывающая система. Длительное действие этих факторов ведет к дилатации сердца, развитию сердечной недостаточности и уменьшению МОК.
8. Уменьшается давление гломерулярной фильтрации, в результате развивается олигурия или анурия. Сужение почечных сосудов сохраняется долгое время после нормализации давления крови. Ишемия вызывает прогрессирующий некроз канальцев. Признаком почечной недостаточности является увеличение содержания мочевины и креатинина.
9. Развитие гиповолемии.
На начальном этапе развития ИТШ под воздействием эндотоксинов расширяются стенки мелких сосудов, повышается сосудистая проницаемость. В результате, несмотря на отсутствие абсолютного дефицита объема, венозный возврат к сердцу уменьшается (относительная гиповолемия). В ответ на это происходит рефлекторное симпатическое сужение вен. Но активное сужение вен эффективно уменьшает венозное кровенаполнение только в том случае, если вены хорошо наполнены и растянуты. Если же давление в венах низкое, даже сильные сокращения гладкой мышцы вен оказывают только незначительное влияние на количество крови в них. В результате снижения венозного возврата повышается активность симпатической нервной системы, что ведет к сокращению капиллярных сфинктеров. В результате кровоснабжение тканей становится недостаточным, ЧСС увеличивается, общее периферическое сопротивление уменьшается и снижается АД.
По мере дальнейшего развития шока происходит формирование рокового порочного круга. Прекапиллярные артериальные сфинктеры более чувствительны к токсическим влияниям, поэтому их спазм быстро сменяется парезом. Посткапиллярные венулярные сфинктеры более устойчивы к метаболическим нарушениям и длительное время остаются в состоянии тонического напряжения. Кровь, притекающая в капиллярное русло депонируется, нарастает тканевая гипоксия, усугубляется метаболический ацидоз, пропотевает плазма с нарастающей компрессией капилляров, что наряду с застоем крови в венозном русле, способствует дальнейшему уменьшению венозного возврата и увеличению относительной гиповолемии.
В результате возникает следующая причинно-следственная связь: стаз в капиллярах — висцеральный застой — уход воды — повышение вязкости крови — агрегация красных и белых кровяных телец, образование красного и белого тромба — истощение факторов свертывания и тромбоцитов вследствие диссеминированного внутрисосудистого свертывания — возникновение коагулопатии с повышенной предрасположенностью к кровотечению.
Патогенетические стадии ИТШ.
Стадия компенсации. Компенсаторные реакции на поддержание АД и восполнение ОЦК. Выброс катехоламинов, вызывающих спазм прекапиллярных сфинктеров. Открываются прямые артериовенозные шунты.
Стадия субкомпенсации. Начальный спазм капилляров сменяется парезом и застоем крови в микроциркуляторном русле. Развивается циркуляторная недостаточность. Компенсаторная тахикардия. Снижается венозный возврат к сердцу и сердечный выброс. При уменьшении венозного возврата на 25–30% начинается декомпенсация со снижением АД и нарушением кровоснабжения жизненно важных органов. Нарастает метаболический ацидоз, тахипное.
Стадия декомпенсации характеризуется присоединением ДВС–синдрома, развитием тканевой гипоксии и изменений в шоковых органах.
В нормальных условиях кровь имеет характер стабильной суспензии. Предвестником ДВС синдрома является сладж феномен (англ. sludge — густая грязь, тина) — изменение реологических свойств крови, характеризующееся прилипанием друг к другу эритроцитов, лейкоцитов и тромбоцитов и повышением вязкости крови, что затрудняет ее перфузию через микрососуды. Сладж может быть обратимым (только при агрегации эритроцитов) и необратимым (при агглютинации эритроцитов).
Ферменты обмена веществ и ферменты-токсины (плазмокоагулаза, коллагеназа, фибринолизин, лецитиназа, гемолизины, ДНК–аза) необходимы микроорганизмам для удовлетворения пищевых потребностей. С помощью ферментов микроорганизмы расщепляют субстраты, входящие в состав мембран клеток макроорганизма. В результате клетки подвергаются деструкции и погибают. Кроме этого, образуются продукты ферментации, обладающие токсическим действием (мочевина, сероводород, амины). Характеристика ферментов:
1. Имеют белковую природу, вырабатываются живыми клетками, способны действовать, после выделения из клетки.
2. Высокая специфичность действия.
3. Один фермент может катализировать распад и синтез субстрата. Направление процесса определяется концентрацией исходных и конечных продуктов превращения.
Сидерофорная системаобеспечивает бактериальные клетки железом.Бактерии, как и макроорганизмы, нуждаются в ионах железа для метаболизма и роста. Бактериальные клетки быстро реагируют на изменение концентрации железа в среде: запасают его при избытке металла в среде и используют в периоды голодания по железу.
В организме человека железо депонируется в биологических жидкостях и тканях. Однако это железо недоступно бактериям, так как связано с гемоглобином в эритроцитах, с трансферрином в плазме, с лактоферрином в секретах.
Для связывания с железосодержащими белками некоторые бактерии образуют рецепторные структуры (трансферринсвязывающий мембранный белок нейссерий). Благодаря этому связыванию железо становится доступным для роста бактерий.
Другие бактерии при отсутствии железа синтезируют сидерофоры —низкомолекулярные органические соединения, обладающие высоким сродством к железу, и поверхностные рецепторы белковой природы, распознающие связанное железо. Константа связывания сидерофоров с ионами железа настолько высока, что позволяет отбивать ионы железа от трансферрина и лактоферрина.
Определение бактериальных эндотоксинов
Для определения пирогенности воды и растворов для инъекций применяют тест на определение эндотоксинов (лимулус-тест или лал-тест). В основе этого теста лежит способность лизата амебоцитов (клеток крови) мечехвоста специфически реагировать с эндотоксинами (липосахаридами) грамотрицательных бактерий. В результате реакции между эндотоксином и лизатом происходит помутнение прозрачной смеси или образование твердого геля, что и служит подтверждением присутствия эндотоксина. Реакция проходит за 30-60 мин. Чувствительность реакции во много раз превышает чувствительность фармакопейного теста на кроликах. Сырьем для получения лал-реагента служит кровь мечехвостов – морских животных, обитающих у берегов Северной Америки, Японии, Китая, Вьетнама, Индии. Лал-реактив получают по следующей схеме: сбор крови в раствор антикоагулянта ® отделение амебоцитов от плазмы центрифугированием ® отмывание амебоцитов ® лизирование амебоцитов ® очистка лизата ® повышение чувствительности лизата ® сублимационная сушка. Перед использованием сублимационно высушенный лизат растворяют в апирогенной воде.
Реакция лизата амебоцитов с эндотоксинами была открыта в США в 1964 г. Первые исследования были проведены на мечехвостах вида Limulus Polyphemus. Лизат, полученный из их крови Limulus Amebocyte Lisate – сокращенно – ЛАЛ-реактив, а сама реакция – ЛАЛ-тест.
Промышленный выпуск ЛАЛ-реактива начался в США в конце 70-х годов XX столетия. В настоящее время в США 10 фирм-производителей выпускают реактив, кроме того, есть производители в Китае и Японии. Выпускаемые препараты отличаются чувствительностью (самый высокочувствительный способен определять 0,01 э.ед./л.), назначением (для определения в фармацевтических препаратах, крови, фильтрах и др.), методикой выполнения анализа (гель-тромб тест, турбидиметрический метод). Срок годности ЛАЛ-реактивов составляет от 2 до 5 лет.
Впервые официально ЛАЛ-тест признан в 1980 г в США. В Федеральном регистре было опубликовано руководство по его применению для контроля медицинских и ветеринарных препаратов. В 1980 г ЛАЛ-тест был включен в XX издание фармакопеи США.
Применение ЛАЛ-теста в медицине и фармации имеет несколько направлений:
1. Применение в клинической практике для диагностики заболеваний, вызванных грамотрицательными микроорганизмами.
2. Применение в фармации для постадийного контроля и оценки качества готового продукта.
Так как приготовление инъекционных средств должно проводиться максимально быстро, ЛАЛ-тест сегодня – единственный реактив, который может быть использован для постадийного контроля растворов для инъекций на апирогенность. Наиболее рациональными точками контроля являются исходное сырье, вода для инъекций, фильтры, растворы перед стерилизующим фильтрованием, ампулы и флаконы. Следует отметить также эффективность ЛАЛ-реактивов для установления режимов работы технологического оборудования – мойки ампул, флаконов, термической депирогенизации и др.
Применение ЛАЛ-теста для постадийного контроля инъекционных растворов позволяет повысить их качество и снизить стоимость затрат. Применение ЛАЛ-теста позволило фирме «Берингер Мангейм» (Германия) сэкономить 1100 кроликов, ликвидировать 280 мест их содержания, в 2 раза уменьшить затраты на питание. На фирме «Хаус Хекст» (Германия) экономия составила 500 мест и 1000 животных.
Лал-тест используется прежде всего для определения содержания эндотоксинов в радиофармацевтических средствах, в тех средствах, которые невозможно оценить на кроликах – седативных, наркотических, а также в лекарственных средствах, не вводимых внутривенно.
В большинстве случаев ЛАЛ-тест, даже если он и включен в Фармакопею, не заменяет тест на кроликах, а является самостоятельным. Это связано с тем, что не всегда прослеживается четкая корреляция между ЛАЛ-тестом и определением апирогенности на кроликах. Определенно установлено следующее: содержание эндотоксина 50 э.ед./л – положительную.
Определение бактериальных эндотоксинов в инъекционных лекарственных средствах проводят в соответствии требованиями ГФ РБ (ГФ РБ, Т. I, Ст. 2.6.14).
РАСТВОРИТЕЛИ ДЛЯ ИНЪЕКЦИОННЫХ РАСТВОРОВ
Вода для инъекций – Аqua pro inectionibus, ГФ РБ. Вода для инъекций должна отвечать требованиям, предъявляемым к воде очищенной и, кроме того, быть апирогенной.
Пирогенные вещества нелетучи и не перегоняются с водяным паром. Однако при интенсивном кипении пар может захватывать капельки жидкости с растворенным в ней пирогенными веществами. Во избежание попадания капель воды в дистиллят в современных аквадистилляторах предусмотрены специальные брызгоулавливающие устройства – сепараторы. Сепараторы бывают центробежные, пленочные, объемные, комбинированные. В центробежных аппаратах создается вращательное движение сепарируемого пара. Под действием ускорения частицы влаги выделяются из потока пара. Пленочные сепараторы состоят из набора пластинок различного профиля, через зазоры которых проходит пар. В объемных сепараторах капли воды выпадают из потока пара под действием сил тяжести. В комбинированных сепараторах используется соединение нескольких видов сепарации.
Используют аппараты АА-1, А-10, АЭВС- 60. Основные части аппаратов: камера испарения с нагревающим устройством, сепаратор, конденсатор, сборник. Для химической обработки воды с целью окисления органических и пирогенных веществ и связывания аммиака имеется дозирующее устройство для подачи растворов калия перманганата и алюмокалиевых квасцов с гидрофосфатом натрия. На 1 л кипящей воды добавляют 0,152 г калия перманганата, 0,228 г алюмокалиевых квасцов и 0,228 г натрия фосфата двузамещенного.
Получение воды для инъекций производится в асептических условиях в помещении водоподготовки. Категорически запрещается выполнять какие-либо работы, не связанные с перегонкой воды. В аптеке назначается лицо, ответственное за сбор и за хранение воды очищенной и воды для инъекций. Полученная вода для инъекций собирается в обработанные паром сборники, чаще всего в стеклянные баллоны. Если сборников несколько, они нумеруются. Сборники снабжаются пробкой с трубкой, в которую помещают стерильную вату. Вату меняют ежедневно. Вода для инъекций может подаваться на рабочее место фармацевта с помощью трубопровода.
Вода для инъекций должна использоваться свежеприготовленная. Хранится в аптеке при температуре от 5 до 25°С. Срок хранения 24 часа.
Для приготовления глазных капель и примочек, растворов для новорожденных детей, отдельных растворов для наружного прим используется вода очищенная.
Образование эндотоксинов. Бактериальные эндотоксины. Результаты и интерпретация
В определённой степени токсигенным микроорганизмам (активно секретирующими токсины) противопоставлены патогенные бактерии, обладающие токсическими субстанциями, слабо диффундирующими в окружающую среду и названные (по предложению Р. Пфайффера) эндотоксинами.
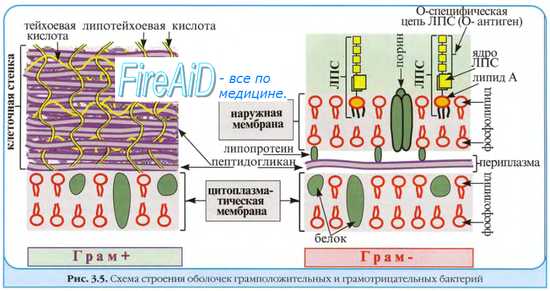
Эндотоксины — интегральные компоненты клеточной стенки грамотрицателъных бактерий; большая их часть высвобождается только после гибели бактериальной клетки. Представлены комплексом протеинов, липидных и полисахаридных остатков. За проявление биологического эффекта ответственны все группировки молекулы эндотоксина.
Биологическая активность напоминает таковую у некоторых медиаторов воспаления; эндотоксинемия обычно сопровождается лихорадкой, обусловленной выбросом эндогенных пирогенов из гранулоцитов и моноцитов. При попадании значительного количества эндотоксина в кровоток возможен эндотоксиновый шок, обычно заканчивающийся смертью больного.
Бактериальные эндотоксины проявляют сравнительно слабое иммуногенное действие, и иммунные сыворотки не способны полностью блокировать их токсические эффекты. Некоторые бактерии могут одновременно синтезировать экзотоксины и выделять (при гибели) эндотоксины (например, токсигенные Escherichia coli и холерные вибрионы).
Экзоферменты
Важными факторами патогенности следует считать экзоферменты (например, лецитиназа, гиалуронидаза, коллагеназа и др.), нарушающие гомеостаз клеток и тканей, что приводит к их повреждению. Способность к образованию экзоферментов во многом определяет инвазивность бактерий — возможность проникать через слизистые оболочки, соединительнотканные и другие барьеры. Например, гиалуронидаза расщепляет гиалуроновую кислоту, входящую в состав межклеточного вещества, что повышает проницаемость различных тканей. Этот фермент синтезируют бактерии родов Clostridium, Streptococcus, Staphylococcus и др, Нейраминидаза облегчает преодоление слоя слизи, проникновение внутрь клеток и распространение в межклеточных пространствах. Нейраминидазу секретируют холерные вибрионы, дифтерийная палочка; он также входит в состав вируса гриппа. К этой же группе следует отнести и бактериальные ферменты, разлагающие антибиотики.
Суперантигены
Некоторые токсины (например, токсин Дика стрептококков или энтеротоксин стафилококков) способны действовать как суперантигены, вызывая поликлональную активацию различных клонов лимфоцитов. Поликлональная активация сопровождается гиперсекрецией лимфокинов с развитием цитокинопосредованной интоксикации.
– Вернуться в оглавление раздела “Микробиология.”



