Профилактика и ранняя диагностика наследственных заболеваний. Наследственные заболевания. Направлению в медико-генетическую консультацию подлежат
Медико-генетическое консультированием как профилактика наследственных заболеваний.
Медико-генетическому консультированию.
Медико-генетическое консультирование – это система оказания специализированной медико-генетической помощи в виде неонатального скрининга на фенилкетонурию и врожденный гипотиреоз; собственно генетического консультирования семей, в которых отмечаются случаи врожденных и наследственных заболеваний (ВНЗ); пренатальной диагностики состояния плода в случае следующей беременности, а также пренатального скрининга беременных (исследования сывороточных материнских маркеров – альфа-фетопротеина (АФП), хорионического гонадотропина (ХГ), неэстерифицированного эстриола (НЭ) и других маркеров).
Медико-генетическое консультированием как профилактика наследственных заболеваний.
Медико-генетическое консультирование (МГК) – это один из видов специализированной медицинской помощи, направленный на предотвращение рождения ребенка с наследственным заболеванием. Впервые медико-генетическая консультация была организована выдающимся отечественным невропатологом С.Н. Давиденковым в конце 20-х гг. прошлого века на базе Института нервно-психиатрической профилактики в Москве, а первый кабинет по медико-генетическому консультированию был открыт в 1941 году в Мичиганском университете в США. Принято считать, что термин «генетическая консультация» был предложен С. Ридом в 1947 г.
Именно он впервые написал краткое руководство по генетическому консультированию. В настоящее время в нашей стране и за рубежом создана сеть медико-генетических консультаций и Центры медико-генетической помощи, основная функция которых заключается в предупреждении возникновения наследственных заболеваний в семье. Ведущим учреждением по генетическому консультированию в нашей стране является Медико-генетический научный центр РАМН в Москве. Значительную работу по медико-генетическому консультированию выполняют Межрегиональные центры в г. Воронеже, Самаре, Санкт-Петербурге, Уфе и др.
Как правило, люди обращаются к врачу-генетику для того, чтобы получить прогноз здоровья будущего ребенка. Наиболее часто врачу генетику приходится проводить, так называемое, ретроспективное консультирование, которое осуществляется в семье, уже имеющей больного ребенка. В этом случае, основная цель генетического консультирования состоит в определении повторного риска рождения больного ребенка в семье и в планировании профилактических мероприятий. Реже врач проводит проспективное консультирование, которое осуществляется в семье, имеющей повышенный риск рождения больного ребенка.
Наиболее часто за такими консультациями обращаются супруги, состоящие в кровном родстве; пары при наличии случаев наследственного заболевания в родословной мужа или жены, а также при воздействии на беременную женщину неблагоприятных средовых факторов.
Безусловно, проспективное консультирование — наиболее эффективный способ профилактики наследственных заболеваний. Особенно большое значение проведение проспективного консультирования приобрело в последнее десятилетие, когда на основании ДНК-анализа стало возможным установление гетерозиготного носительства супругами мутации в одном и том же гене, а также выявление патологических изменений в генотипе на доклинической стадии.
Это позволяет своевременно предупредить консультирующихся о высоком риске возникновения наследственного заболевания или появления у них больного потомства.
Медико-генетическое консультирование состоит из нескольких этапов.
Первый, наиболее важный этап, заключается в постановке диагноза наследственного заболевания и определении типа его наследования.
Второй этап подразумевает установление генотипов консультирующихся и членов их семей с последующим расчетом риска возникновения заболевания.
На третьем этапе исследуется возможность профилактических мероприятий, и определяется наиболее эффективный способ их проведения.
Помимо этих трех основных задач большое значение при консультировании имеет психологическая и правовая помощь. Необходимо объяснить консультирующимся и членам их семей смысл результатов генетических анализов, помочь в решении морально-этических и правовых проблем, оказать психологическую помощь по решению вопросов планирования семьи, социальной адаптации и тл.
Первый этап медико-генетического консультирования заключается во всестороннем обследовании больного, направленном на уточнение диагноза. Значительное внимание на этом этапе уделяется сбору генеалогической информации и анамнестических данных. Предположение о наследственном характере заболевания и установление типа его наследования может быть сделано на основании анализа родословной пробанда и тщательном обследовании всех членов консультирующейся семьи. При наличии сегрегации заболевания в родословной можно с высокой долей вероятности прогнозировать генотип всех родственников пробанда и определить круг лиц нуждающихся в проспективном и ретроспективном МГК.
Уточнение нозологической формы наследственного заболевания должно проводиться с использованием всех доступных методов обследования. В первую очередь осуществляется клинический осмотр больного и членов его семьи с целью выявления фенотипических проявлений болезни. Учитывая варьирующую экспрессивность большинства наследственных патологий, особое значение должно придаваться тщательности физикального обследования, при котором необходимо обращать внимание на малейшие признаки болезни. Врач-генетик должен быть знаком со всеми клиническими симптомами наследственных заболеваний и учитывать возможность существования стертых и атипичных форм. Этап постановки диагноза может быть ограничен использованием только клинического обследования больного.
Это происходит в двух случаях:
1) если фенотипические проявления заболевания позволяют четко и однозначно поставить диагноз и семья не нуждается в дородовой диагностике;
2) если этиология и патогенез заболевания не известны и использование дополнительных генетических методов для уточнения диагноза невозможно. Иногда для уточнения диагноза необходимы дополнительные консультации специалистов различного профиля (офтальмолога, невропатолога, ортопеда и др.), а также лабораторное и инструментальное обследование. В последние годы при проведении диагностической процедуры достаточно широко используются компьютерные базы данных и информационно-диагностические системы, такие как POSSUM, LDDB, SYNGEN, CHRODYS, MEDGEN идругие.
Данные клинического осмотра, выявление характерных симптомов и параклинических признаков, позволяют предположить у консультируемого определенное наследственное заболевание. Для подтверждения диагноза необходимы специальные методы обследования. К таким методам относятся, прежде всего, цитогенетические, биохимические и молекулярно-генетические.
Решение о необходимости исследования кариотипа больного и/или членов его семьи врач принимает на основании наличия признаков, характерных для хромосомной патологии.
При подозрении на наследственную болезнь обмена проводят биохимическое исследование. На первом этапе такого исследования определяют концентрации в крови или моче метаболитов, накапливающихся при нарушении обменных превращений определенных субстратов, вводимых с пищей или синтезирующихся в организме. Если концентрация каких-то метаболитов повышена, можно сделать заключение о нарушении метаболизма определенных веществ и перейти ко второму этапу биохимического исследования. Его цель – определить снижена ли активность ферментов, участвующих в метаболизме этих веществ. В качестве примера такого двухэтапного обследования можно привести схему диагностики одной из групп болезней накопления — мукополисахаридозов.
На первом этапе у больных с клиническими симптомамипроводят исследование концентрации гликозамингликанов в мочегепарансульфата, дерматансульфата, кератансульфата, хондроитин-4 и хондроитин – 6 сульфатов. При увеличении концентрации тех или иных метаболитов, в зависимости от их сочетания, планируется последовательность этапов проведения энзимодиагностики с целью идентификации нозологической формы мукополисахаридоза.
При других моногенных заболеваниях точная диагностика генетического варианта наследственного заболевания возможна на основании проведения ДНК-анализа, направленного на выявление мутации в тех или иных генах. Схема проведения молекулярно-генетической диагностики описана в нашей статье, а особенности ДНК-диагностики отдельных моногенных заболеваний представлены в наших статьях.
Существует два основных подхода, позволяющих выявлять генотипы, определяющие высокий риск развития заболевания у будущего ребенка — это пренатальная и преимплантационная диагностика.
Выделяют два направления профилактики врожденных и наследственных заболеваний: индивидуальная (семейная) профилактика путем медико-генетического консультирования обратившихся в МГК и популяционная профилактика, которая включает:
1) реализацию специальных программ скрининга наследственных болезней,
2) выявление гетерозиготных носителей мутантных генов,
3) проведение различных санитарно-гигиенических мероприятий, направленных на уменьшение отрицательных влияний окружающей среды.
Несмотря на различия этих направлений, их общим звеном является проведение медико-генетического консультирования.
Важнейшим условием успешного медико-генетического консультирования является точность диагноза. Точность диагноза чрезвычайно важна, так как в более 75 % обследованных семей речь идет об изолированном проявлении врожденной аномалии в семье и диагноз в таком случае является исходным пунктом для составления генетического прогноза.
Важной составляющей медико-генетического консультирования является помощь обратившемуся больному или его родственникам адаптироваться к полученной генетической информации.
К сожалению, уровень обращаемости населения в МГК России по поводу медико-генетического консультирования низок и составляет от 0,3 % до 0,5 % всех семей (в абс. цифрах 350-400 тыс. обращений в год), но расчеты показывают, что она должна составлять около 8 %.
Чаще всего обращаются больные с хромосомными болезнями, врожденными пороками развития и нервно-психическими заболеваниями. Следует отметить, что врач-генетик имеет дело с семьями, в которых существуют конфликтные взаимоотношения (в 50 %) между супругами, что важно учитывать при выдаче заключения. Сильным вариациям подвержены и процентные соотношения больных, направленных врачами, и самостоятельно обратившихся в разные территориальные МГК. Доля самостоятельно обратившихся имеет размах от 10 до 80 %. Однако в целом число обращений по направлениям врачей возрастает и в последние годы составляет около 70 %. На уровень обращения большое влияние оказывает степень информированности врачей общей практики в вопросах генетики и понимание информации родителями и населением.
Вторым этапом медико-генетического консультирования является расчет повторного генетического риска, базирующегося на теории вероятностей.
Существуют два принципиальных подхода к оценке генетического риска:
1) теоретические расчеты, основанные на законах формальной генетики,
2) эмпирические данные, использующие нередко эмпирические показатели частоты среди родственников определенных степеней родства в качестве повторного риска.
Различают ретроспективное консультирование (в семье уже есть больной ребёнок) и перспективное (до рождения первого ребёнка).
Основные направления профилактики, ранней диагностики и лечения врожденных и наследственных болезней у детей
_Title Основные направления профилактики, ранней диагностики и лечения врожденных и наследственных болезней у детей
_Author
_Keywords
П. В. Новиков , МНИИПиДХ Минздрава России, г. Москва
Профилактика врожденных и наследственных болезней является главным направлением деятельности МГС Российской Федерации и ее значимость возрастает по мере улучшения состояния здоровья населения и здравоохранения, особенно с повышением уровня охраны здоровья матери и ребенка. Эффективность профилактики наследственной патологии становится особенно заметной в тех регионах, где уровень младенческой смертности ниже 15 на одну тысячу родившихся детей.
Перелом во взглядах на профилактику НБ произошел в 60—70-х годах ХХ века в связи с разработкой методов профилактического лечения, преклинической (в том числе пренатальной) диагностики, методов выявления скрытого носительства патологических генов.
Программа профилактики врожденных и наследственных заболеваний должна базироваться на данных о «грузе» наследственной патологии, который в обобщенном виде составляет 30—60 на 1000 живорожденных. По расчетным данным в России ежегодно рождается от 35 до 75 тысяч детей с наследственными болезнями. При этом в структуре наследственных болезней доля тяжелых форм патологии составляет около 2 %.
Суммарно растет вклад наследственной патологии в структуру причин детской инвалидности, детской заболеваемости, среди госпитализированных детей в больницы общего профиля. Социальная адаптация у детей с генетически детерминированными состояниями, их нервно-психическое и физическое развитие резко снижены, почти у 75% детей, страдающих наследственной патологией, отмечается низкий уровень способностей к обучению в школе или к работе. Важность и необходимость профилактики наследственных болезней, таким образом, определяется с экономической, здравоохраненческой и социальной точек зрения.
Пути профилактики наследственной патологии включают следующие уровни: прегаметический (охрана репродуктивного здоровья; охрана окружающей среды); презиготический (медико-генетическое консультирование, искусственная инсеминация, периконцепционная профилактика); пренатальный (внедрение всех видов дородовой диагностики); постнатальный (ранняя идентификация патологии, лечение, профилактика инвалидизирующих расстройств).
Можно выделить несколько организационных форм профилактики врожденных и наследственных болезней:
1) диагностика гетерозиготного носительства;
2) пренатальная (дородовая) диагностика и внутриутробная коррекция патологии плода;
3) преклиническая (досимптоматическая) диагностика;
4) медико-генетическое консультирование;
5) ранняя постнатальная диагностика (идентификация) наследственных болезней, поддающихся лечению;
6) диспансеризация семей с наследственной патологией;
7) контроль мутагенности факторов окружающей среды и гигиеническая регламентация (профилактика новых мутаций);
8) пропаганда медико-генетических знаний.
Главными из них являются: медико-генетическое консультирование на основе точной верификации патологии, доклиническая диагностика болезней у новорожденных, пренатальная диагностика.
На решение этих задач направлены приказы Минздрава России «О дальнейшем развитии медико-генетической службы Министерства здравоохранения Российской Федерации»(1993 г.), «О совершенствовании пренатальной диагностики наследственных и врожденных заболеваний у детей» (2000 г.), «О создании Федеральной системы эпидемиологического мониторинга врожденных и наследственных заболеваний и пороков у детей» (1997 г.), «О мониторинге ВПР у детей»(1998 г.), а также решения Коллегии и консультативно-методического Совета по медицинской генетике Министерства, использование достижений медицинской генетики и смежных научных дисциплин.
Актуальной остается проблема ранней диагностики врожденных и наследственных заболеваний в детском возрасте. Сопоставление направительных и окончательных диагнозов более, чем у 5000 детей, госпитализированных в генетическую клинику МНИИ педиатрии и детской хирургии Минздрава России, показало, что трансформация диагнозов наблюдалась в 65-70% случаев. Наибольшие трудности вызывала идентификация наследственных болезней среди недифференцированных форм патологии, связанных с задержкой нервно-психического развития, отклонений роста и физического развития, множественных пороков и аномалий. Ранняя диагностика базировалась на широком использовании современных методов обследования: массовый скрининг новорожденных на наследственные дефекты обмена (в России — на ФКУ и врожденный гипотиреоз), молекулярно-генетические и цитогенетические исследования, методы аналитической биохимии, хромато-масс-спектрометрии, флюорометрии, флюоресцентного анализа, программы селективного скрининга и др.
При обсуждении возможных путей коррекции наследственных болезней правомерно выделить два основных направления, возможности практического использования которых неравнозначны. Первый наиболее перспективный путь — путь радикального устранения генетического дефекта. Генная инженерия, несомненно, открывает широкие возможности в лечении как самого больного, при переносе клонированных генов в соматические клетки, так и в предупреждении заболевания у его потомства, при переносе генов в половые клетки, если внесенный ген будет встроен в геном. Однако, для реализации практического решения этой проблемы потребуются определенные сроки.
В связи с этим особенно важное значение в лечении наследственных болезней обмена веществ приобретает второй путь — путь патогенетической, заместительной, корригирующей и симптоматической терапии, при которой предпринимаются попытки нормализации нарушений без прямого воздействия на основной генетический дефект.
При лечении наследственных нарушений обмена веществ с известным уровнем и характером метаболического блока нами широко использовались: диетотерапия с исключением поступления с пищей тех веществ, концентрация которых в крови повышена (ФКУ, гомоцистиурия, тирозинемия, болезнь мочи кленового сиропа др.), однако внедрение этого направления сдерживается дефицитом выпуска отечественных спецпродуктов; кофакторная терапия при наследственных нарушениях взаимодействия кофакторов с апоэнзимом (пиридоксина при гомоцистинурии, В-12 при метилмалоновой ацидемии, витамина D и его метаболитов наследственном рахите и др.); гормональная терапия (соматотропины, тироксин, кальцитонин и др.); психостимуляторы и лазерная акупунктура для коррекции умственных дефектов; методы физиотерапии; хирургическая коррекция врожденных пороков и др.
Перспективы дальнейшего прогресса в этой области в значительной мере связаны с расширением и углублением исследований патогенетических механизмов генетически детерминированных состояний, с широким внедрением в практику разнообразных методов пре- и постнатальной диагностики наследственных болезней и дефектов, в частности с углублением и расширением научных разработок в области антенатального диагноза наследственных нарушений обмена веществ. Не менее важно совершенствование методов выявления гетерозиготного носительства, создание Федерального генетического регистра. Важное значение имеет подготовка высококвалифицированных кадров по клинической генетике как в отдельных регионах, так и в масштабе всей страны.
Основные этапы и методы медико-генетического консультирования. Профилактика наследственных болезней
Медико-генетическое консультирование (МГК)- это один из видов специализированной медицинской помощи, направленный на предотвращение рождения ребенка с наследственным заболеванием
Как правило, люди обращаются к врачу-генетику для того, чтобы получить прогноз здоровья будущего ребенка. Наиболее часто врачу генетику приходится проводить, так называемое, ретроспективное консультирование, которое осуществляется в семье, уже имеющей больного ребенка. В этом случае, основная цель генетического консультирования состоит в определении повторного риска рождения больного ребенка в семье и в планировании профилактических мероприятий. Реже врач проводит проспективное консультирование, которое осуществляется в семье, имеющей повышенный риск рождения больного ребенка.
Наиболее часто за такими консультациями обращаются супруги, состоящие в кровном родстве; пары при наличии случаев наследственного заболевания в родословной мужа или жены, а также при воздействии на беременную женщину неблагоприятных средовых факторов.
Медико-генетическое консультирование состоит из нескольких этапов. Первый, наиболее важный этап, заключается в постановке диагноза наследственного заболевания и определении типа его наследования. Второй этап подразумевает установление генотипов консультирующихся и членов их семей с последующим расчетом риска возникновения заболевания. На третьем этапе исследуется возможность профилактических мероприятий, и определяется наиболее эффективный способ их проведения. Помимо этих трех основных задач большое значение при консультировании имеет психологическая и правовая помощь. Необходимо объяснить консультирующимся и членам их семей смысл результатов генетических анализов, помочь в решении морально-этических и правовых проблем, оказать психологическую помощь по решению вопросов планирования семьи, социальной адаптации и тл.
30. Характеристика методов пренатальной диагностики
Пренатальная диагностика — дородовая диагностика, с целью обнаружения патологии на стадии внутриутробного развития. Позволяет обнаружить более 90 % плодов с синдромом Дауна (трисомия 21); трисомии 18 (известной как синдром Эдвардса) около 97 %, более 40 % нарушений развития сердца и др. В случае наличия у плода болезни родители при помощи врача-консультанта тщательно взвешивают возможности современной медицины и свои собственные в плане реабилитации ребенка. В результате семья принимает решение о судьбе данного ребенка и решает вопрос о продолжении вынашивания или о прерывании беременности.
К пренатальной диагностике относится и определение отцовства на ранних сроках беременности, а также определение пола ребенка.
Методы пренатальной диагностики
Анализ родословной родителей
Генетический анализ для родителей
Инвазивные (разрушающие) методы пренатальной диагностики
Плацентоцентез (поздняя биопсия хориона)
Неинвазивные (неразрушающие) методы пренатальной диагностики
Ультразвуковой скрининг плода, оболочек и плаценты
Сортинг фетальных клеток
Предмет экологии человека.Биологические и социальные адаптации населения к условиям жизнедеятельности.Уровни экологических связей человека(индивидуальный,групповой,глобальный,)
Датой рождения экологии как науки следует считать 1866 год, когда немецкий биолог Эрнест Геккель предложил термин “экология” (дословно – “наука о местообитании”).
Появление науки экологии совпало с бурным развитием промышленности и городов. Совпадение не случайно. Эксплуататорский подход по отношению к природным ресурсам (за относительно короткий срок для истории человечества) сопровождался всё более частыми нарушениями экологического равновесия в окружающей среде (производство продуктов питания растёт медленнее, чем прирост населения).
Возрастающее влияние производственной деятельности человека на окружающую среду в наши дни оказывает не только прямое отрицательное действие на человека, но и опосредованно за счёт изменений природной среды (вырубка лесов – разрущение почвы; загрязняющие почву химические вещества губят микроорганизмы, земля становится “мёртвой”, ничего не растёт).
Воздействие человека на биосферу приблизилось к критическому и грозит необратимыми последствиями для сохранения человечества и планеты Земли в целом.
Экология человека это не только накопление конкретных знаний, это наука, ищущая методы нравственного и духовного воспитания человека, пути перестройки его мышления для осознания своей роли в природе (гражданская ответственность за состояние окружающей среды).
Изучение указанных вопросов особенно важно в системе медицинского образования, т.к. медработник способен через систему гигиенического образования и воспитания донести экологические знания до широких групп населения. Кроме того, знание основ экологии позволяет осознать, что для сохранения здоровья необходима здоровая среда обитания, что составляет основу экологического мышления.
В современной экологии выделяют 3 раздела:
1. Факториальная экология – изучает совокупность экологических факторов, влияющих на особь и ответные реакции особи на их действие.
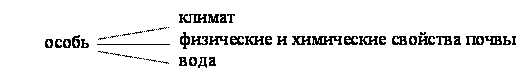
2. Популяционная экология – изучает жизнь отдельных популяций, определяет причины их изменений.
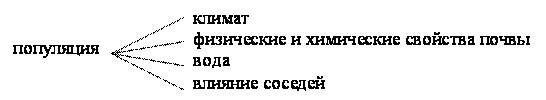
Под влиянием различных факторов число особей популяции, её возрастной состав и область распространения могут значительно изменяться во времени. Эти изменения могут привести к неблагоприятным последствиям (вспышка численности насекомых-вредителей – урон сельскому хозяйству).
3. Биогеоценология изучает взаимоотношения внутри экосистемы (лес, водоём, почва).
Пример: сточные воды, содержащие органические вещества, состоят из таких биогенных элементов как азот и фосфор. Резкое увеличение этих веществ в воде водоёма вызывает быстрое размножение сине-зелёных и бурых водорослей, фитопланктона, в результате чего повышается потребление кислорода. Снижение содержания кислорода в воде делает её непригодной для жизни. Водоём как экосистема погибает.
Экология человека (или социальная экология) – это область экологии, изучающая взаимодействие человеческого общества и окружающей среды. Она выделилась (сформировалась) в 70-е гг. XX века как самостоятельный раздел общей экологии, главной особенностью которого является междисциплинарный характер, т.к. в нём обобщены социологические, философские, географические, естественно-научные и медико-биологические проблемы.
Экология человека изучает закономерности возникновения, существования и развития антропоэкологических систем. Размеры таких систем различны в зависимости от численности и характера организации человеческих популяций. Это могут быть изоляты, демы, нации, наднациональные ассоциации (различающиеся по способу производства, укладу жизни) и, наконец, человечество в целом.
Большое значение в определении размера антропоэкологической системы имеют природные условия: наиболее многочисленные современные популяции, объединяющие более 80% человечества, обитают на 44% суши в области тропических лесов и саванн. В засушливых зонах (18% суши) обитает лишь 4% населения.
Главная отличительная черта антропоэкологических систем -наличие в их составе человеческих сообществ, которым в развитии всей системы принадлежит доминирующая роль. Сообщества людей различаются по способу производства материальных ценностей и структуре социально-экономических отношений. Активностью сообществ людей на занимаемой территории определяется уровень воздействия их на окружающую среду. Развивающиеся сообщества (например, в период индустриализации) характеризуются ростом численности населения и увеличением потребностей его в продуктах питания, сырье, водных ресурсах, размещении отходов. В таких сообществах увеличена нагрузка на природную среду, интенсифицировано использование биотических и абиотических факторов.
В антропоэкологических системах процессы осуществляются в двух главных направлениях: 1) изменяются биологические и социальные показатели индивидуумов и сообщества в целом как ответ на требования, предъявляемые человеку средой; 2) осуществляется перестройка самой среды для удовлетворения требований человека. В истории человечества усиливалась роль второго направления.
Адаптации человека к условиям обитания имеют частично экологическую, но главным образом социальную природу. Адаптации формируются по отношению к факторам как природной, так и искусственной среды, поэтому они носят не только экологический, но и социально-экономический характер. Экологические и социально-экономические адаптации дополняются психологическими адоптациями, поскольку каждый человек индивидуален.
Индивидуальные и групповые адаптации человека, в отличие от биологических адаптации растений и животных, обеспечивают наряду с выживанием и воспроизведением потомства выполнение им социальных функций, важнейшей из которых является общественно – полезный труд. Индивидуальные и групповые адаптации человека включают оптимизацию условий жизни и производственной деятельности (устройство жилищ и других помещений, конструкцию одежды, организацию питания и водоснабжения, рациональный режим труда и отдыха, сознательную тренировку организма и др.).
Хотя в основе адаптации человека лежат социально-экономические механизмы, важная роль принадлежит также естественным приспособительным и защитным механизмам, которые составляют биологическое наследство человека. Хорошо иллюстрируется роль естественных механизмов при переходе человека в экстремальные условия местообитаний (высокогорье; Арктика с её суровым климатом, необычными атмосферными явлениями и пониженным содержанием микроорганизмов в почвах и воздухе, специфической сменой дня и ночи). Как правило, люди, привыкшие жить в умеренных широтах, при перемещении в Заполярье болезненно реагируют на перемены, испытывают болезненные ощущения и длительно могут находиться в ухудшившемся состоянии (повышается артериальное давление, учащается пульс, падает работоспособность, снижается до 3000-3500 в 1 мм3 количество лейкоцитов). По прошествии определённого времени функциональные показатели возвращаются к нормальному уровню, восстанавливается работоспособность, оперативная память, защитные механизмы организма. Происходит акклиматизация человека к новым условиям обитания, основным критерием которой является восстановление высокого уровня трудоспособности. В основе акклиматизации лежат естественные приспособительные механизмы организма человека.
Продолжительное проживание групп людей на территориях, различающихся климатическими, алиментарными и другими экологическими факторами, привело к образованию воспроизводящихся в ряду поколений признаков и их комплексов. В результате возникли экологические типы людей, обладающие более высоким уровнем приспособленности (за счёт естественных адаптационных механизмов) к проживанию в конкретной биогеографической среде.
Однако перед человечеством стоит серьёзная задача более глубокого освоения мало – или совсем незаселённых территорий, которые составляют 71% поверхности Земли (пустыни, полупустыни, высокогорные, полярные, тропические районы, дно морей и океанов). Кроме того, человек в результате своей хозяйственной деятельности сам создаёт экстремальные условия среды, к которым ему необходимо адаптироваться. Это также одна из серьёзных медико-биологических проблем экологии человека.
Адаптации человека к факторам окружающей среды носят опосредованный характер. Действие экологических факторов всегда опосредовано результатами производственной деятельности людей. В процессе труда человек своей собственной деятельностью опосредует, регулирует и контролирует обмен веществ между своим организмом и природой. К тому же естественные экосистемы в настоящее время всё больше вытесняются антропогенными экосистемами, в которых человек является абсолютно доминирующим экологическим фактором.
Дата добавления: 2018-09-20 ; просмотров: 280 ;
МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ И ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА НАСЛЕДСТВЕННЫХ ЗАБОЛЕВАНИЙ
Наследственные заболевания (нарушение генетического аппарата) и врожденные пороки развития (без нарушения генетического аппарата) занимают 2—3-е место среди всех причин перинатальной смертности. Известно более 2500 нозологических форм наследственных заболеваний, которые поражают все органы, системы организма и нарушают его функции. Тяжелая наследственная патология, вызывающая гибель или инвалидизацию ребенка, встречается в 1—2 % случаев.
Для большинства наследственных заболеваний, как правило, отсутствует эффективная терапия, поэтому важная роль принадлежит профилактике этой патологии, которую осуществляют с помощью медико-генетического консультирования, пренатальной диагностики, определения гетерозиготного носительства и преклинической диагностики.
Существуют следующие группы наследственных заболеваний: многофакторные, моногенные и хромосомные.
Самая большая группа заболеваний, выявляемых при медико-генетическом консультировании, — это многофакторные,или полигенные, заболевания.Они обусловлены взаимодействием нескольких генов и факторов окружающей среды. В одних случаях превалирует наследственный, в других — сре-довой компонент.
Среди факторов окружающей среды, которые могут оказать неблагоприятное воздействие на плод, особенно в I триместре беременности, следует выделить различные химические соединения, ионизирующую радиацию,
лекарственные препараты (антибластические, некоторые антибиотики и др.), вирусные заболевания (например, краснуха).
Генетическую опасность ионизирующей радиации для человека оценить очень трудно, поэтому все манипуляции, при которых происходит облучение гонад, нужно проводить по строгим показаниям. Особенно нежелательны такие исследования, как урография, гистеросальпингография в самые ранние сроки беременности. После приема цитостатических препаратов необходимо предохранение от беременности в течение 3 мес.
Генетический риск повторного появления многофакторной патологии обычно не превышает 5 %. К таким заболеваниям относятся изолированные пороки развития (например, анэнцефалия, различные грыжи и расщелины, пороки сердца), некоторые формы шизофрении, гипертоническая болезнь, атеросклероз и др.
Вторая группа — моногенные заболевания обусловлены патологией одного гена. Известны 3 типа моногенных заболеваний: с аутосомно-доминант-ным, аутосомно-рецессивным типом наследования и заболевания, сцепленные с полом.
Заболевания с аутосомно-доминантньш типом наследования характеризуются одинаковой частотой поражения лиц разного пола; наличием патологии у одного из родителей; передачей заболевания из поколения в поколение, т.е. по вертикали в 50 % случаев.
К этим заболеваниям относятся ахондроплазия, синдром Марфана, синдром Элерса—Данлоса, нейрофиброматоз и др. Как правило, эти заболевания жизненно не опасны, имеют высокую проявляемость (пенетрантность), четкий тип наследования.
Диагноз и прогноз для потомства не вызывают особых трудностей. Оценка степени риска усложняется, если болезнь не прослеживается в родословной, а появляется спорадически. В этом случае она возникает впервые в семье вследствие изменений (мутации) в половых клетках одного из родителей, прогноз для потомства при последующих беременностях обычно благоприятный. Рождение ребенка с ахондроплазией у фенотипи-чески здоровых родителей не грозит повторением этого заболевания у последующих детей.
Заболевания с аутосомно-рецессивным типом наследования характеризуются одинаковой частотой поражения лиц разного пола; отсутствием болезни у родителей (они, как правило, являются гетерозиготными носителями патологического гена); передачей заболевания от здоровых родителей детям, т.е. по горизонтали в 25 % случаев; увеличением частоты их при кровнородственных браках. Эти заболевания имеют тяжелое течение и высокую летальность. Примерами подобных заболеваний являются многочисленные энзимопатии, фенилкетонурия, врожденная гиперплазия коры надпочечников (адреногенитальный синдром), гипотиреоз, муковисцидоз; некоторые наследственные заболевания кожи (буллезный эпидермолиз, ихтиозиформ-ная эритродермия) и др.
При заболеваниях, сцепленных с полом, обычно поражаются лица мужского пола; мать является гетерозиготной носительницей патологического гена; заболевание передается 50 % сыновей; все дочери больного отца будут гетерозиготными носительницами.
Примерами заболевания этого типа являются гемофилия, миопатия Дюшенна, агаммаглобулинемия и др.
Третью группу наследственных заболеваний представляют хромосомные болезни.Для них характерно наличие множественных врожденных пороков развития; нарушение функции органов и систем, в первую очередь нервной и эндокринной; отставание в умственном развитии. Клиническими симптомами хромосомных заболеваний могут явиться аменорея и бесплодие. Заболевания, обусловленные численным изменением хромосом, возникают случайно и при последующих беременностях повторяются очень редко. Их возникновению способствуют те же факторы, которые обусловливают многофакторную патологию. Наиболее распространенными заболеваниями этой группы являются болезнь Дауна (трисомия по 21-й паре хромосом), синдром Патау (трисомия по 13-й паре хромосом), синдром Эдвардса (трисомия по 18-й паре хромосом), синдром Шерешевского—Тернера (моносо-мия X), синдром Клайнфелтера (кариотип 47, XXY) и др. Четко установлено влияние возраста матери на рождение ребенка с болезнью Дауна. Для молодых женщин (до 35 лет) популяционный риск составляет 1:700. Для женщин в возрасте 35—40 лет он увеличивается до 1:300 — 1:100, а после 40 лет —до 1:100— 1:40.
Кроме количественных, возможны структурные изменения хромосом, которые характеризуются потерей (делецией) или перемещением (транслокацией) части или целой хромосомы на другую. Эти формы хромосомных заболеваний в основном имеют наследственный характер. Вероятность рождения больного ребенка в таких семьях составляет 2—20 % и зависит от характера перестройки, пола и возраста носителя.
Медико-генетическое консультирование— один из видов специализированной помощи населению, направленной главным образом на выявление генетического риска и предупреждение появления в семье больных с наследственной патологией.
Основные задачи медико-генетического консультирования:
1) установление точного диагноза наследственного заболевания;
2) определение типа наследования заболевания в данной семье;
3) расчет риска повторения болезни в семье;
4) определение наиболее эффективного способа профилактики.
Генетический риск— это вероятность появления определенной наследственной патологии у обратившегося за консультацией или у его потомков. Он определяется путем расчетов, основанных на анализе генетических закономерностей, или с помощью эмпирических данных. Возможность рассчитать генетический риск зависит в основном от точности диагноза и полноты генеалогических данных.
Генетический риск до 5 % оценивается как низкий и не считается противопоказанием к деторождению в данной семье. Риск от 6 до 20 % принято считать средним. В этом случае рекомендации относительно планирования дальнейших беременностей зависят от тяжести медицинских и социальных последствий конкретного наследственного заболевания и от возможности проведения пренатальной диагностики. Риск более 20 % считается высоким, и в отсутствие методов пренатальной диагностики соответствующей патологии дальнейшее деторождение в данной семье не рекомендуется.
Основные показания к направлению супружеских пар на медико-генетическое консультирование:
1) рождение ребенка с наследственными заболеваниями или пороками
развития;
2) наличие у одного из супругов хромосомной перестройки, наследст
венного заболевания или порока развития;
3) кровнородственный брак;
4) возраст матери старше 35 лет;
5) неблагоприятное воздействие факторов окружающей среды в ранние
сроки беременности;
6) наличие самопроизвольных выкидышей, мертворождения, первич
ной аменореи, первичного бесплодия супругов;
7) угроза прерывания беременности с ранних сроков;
8) прием лекарственных препаратов в ранние сроки беременности.
В зависимости от характера заболевания при консультировании используют различные методы обследования больного и его родственников, основными из которых являются клинико-генеалогический, цитогенетический, биохимический, иммунологический, молекулярно-генетический (ДНК-анализ), методы пренатальной диагностики.
Клинико-генеалогический метод, или метод сбора и анализа родословной, дает необходимую информацию для постановки диагноза или установления этиологической природы заболевания. Одной из основных задач генеалогического метода является установление наследственного характера заболевания с последующим уточнением его формы и типа передачи.
Цитогенетический метод позволяет непосредственно изучить весь хро
мосомный набор человека (кариотип). Определение кариотипа показано
детям с множественными пороками развития или умственной отсталостью
их родителей; женщинам, страдающим невынашиванием беременности,
имеющим в анамнезе мертворожденных или умерших от неясных причин
детей в раннем возрасте; лицам с первичной аменореей или нарушением
половой дифференцировки. i
Внедрение методов пренатальной диагностики значительно повысило эффективность медико-генетического консультирования и позволило перейти от вероятностного к однозначному прогнозу здоровья потомства. Применяют две группы методов пренатальной диагностики — неинвазивные и инвазивные.
Неинвазивные методы пренатальной диагностики (ультразвуковое исследование в I и II триместрах, определение альфа-фетопротеина, хориони-ческого гонадотропина и неконъюгированного эстриола в сыворотке крови матери во II триместре беременности, выявление внутриутробного инфицирования) являются скринирующими, т.е. они могут быть использованы при обследовании всех беременных.
К инвазивным методам пренатальной диагностики относятся амниоцен-тез, биопсия хориона (или плаценты), кордоцентез (получение крови плода из сосудов пуповины) и биопсия кожи плода. С их помощью получают клетки плода для цитогенетического, биохимического, молекулярно-генети-ческого и других видов анализа.
Особое место в пренатальной диагностике занимает ультразвуковое исследование (УЗИ). Существует четкая зависимость между характером порока и сроком его выявления с помощью УЗИ. Ряд пороков развития можно диагностировать в конце I — начале II триместра беременности. К таким порокам развития относятся анэнцефалия, голопрозэнцефалия, экзэнцефа-
лия, лимфангиомы шеи, омфалоцеле, гастрошизис, неразделившиеся плоды, амелии, ахондрогенез, черепно-мозговые и спинномозговые грыжи, поли-кистоз почек, несовершенный остеогенез и др. Точность диагностики этих пороков развития к концу II триместра беременности приближается к 100 %. Точность диагностики врожденных пороков плода в популяции составляет 87 %, в группе повышенного риска — 90 %.
Отсутствие эхографического изображения врожденного порока развития при первом или повторном УЗИ еще не исключает его появления в более поздние сроки. Ложноотрицательные результаты в основном обусловлены проведением исследования до появления видимых анатомических изменений, наличием небольших пороков развития (чаще всего сердца, лицевой части черепа, дистальных отделов конечностей).
Для своевременной диагностики врожденных пороков развития плода необходима четкая организация ультразвукового скрининга: его необходимо проводить всем беременным не менее 3 раз в течение беременности (в 10—12, 20—22 и 30—32 нед), а по показаниям (анамнез или подозрение на порок развития) чаще (через 3—4 нед) и с тщательным исследованием всех органов и систем плода.
Определение альфа-фетопротеина и других маркеров в сыворотке крови женщины производится на 16—20-й неделе беременности.
Повышение содержания альфа-фетопротеина в сыворотке крови беременных дает возможность выделить среди них женщин с риском развития порока нервной системы плода (расщелины спинного мозга, анэнцефалия). В дальнейшем диагноз уточняется с помощью УЗИ и определения альфа-фетопротеина в амниотической жидкости.
Установлена связь между снижением содержания альфа-фетопротеина в сыворотке крови матери и болезнью Дауна у плода. Низкий уровень альфа-фетопротеина в сочетании с увеличением содержания хорионического гонадотропина и уменьшением уровня эстриола является показанием к проведению амниоцентеза или кордоцентеза с последующим определением кариотипа плода.
В ранние сроки беременности для пренатальной диагностики применяется биопсия хориона. Оптимальным для выполнения этой процедуры является срок 8—11 нед беременности. Получение ткани хориона показано в следующих случаях:
1) изменение кариотипа у одного из родителей;
2) возраст матери старше 35 лет;
3) наличие в семье ребенка с хромосомной патологией, сцепленными
с полом заболеваниями, нарушениями обмена веществ, гемоглоби-
нопатиями.
Иногда в качестве диагностического материала используют ткань плаценты, полученную с помощью плацентоцентеза во II триместре беременности. Показания к проведению плацентоцентеза те же, что и к биопсии хориона.
Амниоцентез во II триместре беременности как метод пренатальной диагностики получил наиболее широкое распространение. В настоящее время применяется практически только трансабдоминальный метод. Оптимальным для его проведения является срок 17—20 нед беременности. При исследовании амниотической жидкости можно определить кариотип плода, уровень содержания различных ферментов, гормонов, альфа-фетопроте-
ин; провести анализ ДНК и, таким образом, диагностировать хромосомную патологию плода, некоторые аутосомно-рецессивные и наследуемые сцепленные с полом заболевания, пороки развития ЦНС. В ряде случаев амни-оцентез можно провести в I триместре беременности для диагностики врожденной гиперплазии коры надпочечников и хромосомной патологии.
Основным методом получения крови плода является кордоцентез (пункция сосудов пуповины). Его можно проводить в амбулаторных условиях начиная с 17 нед беременности. Исследуя кровь плода, можно диагностировать наследственные иммунодефицитные состояния, болезни крови, внутриутробное инфицирование плода, метаболические нарушения. В течение 3—4 нед можно определить кариотип плода.
Во II триместре беременности возможно проведение биопсии кожи плода. Биопсию кожи плода и последующее морфологическое исследование проводят с целью пренатальной диагностики некоторых заболеваний кожи, в первую очередь с аутосомно-рецессивным типом наследования, в частности летального буллезного эпидермолиза, ихтиозиформной эритродермии Брока. Помимо перечисленных, существуют другие инвазивные методы пренатальной диагностики, такие как фетоамниография и фетоскопия. Ранее их использовали для выявления некоторых пороков развития и получения крови и кожи плода во II триместре беременности. В настоящее время они практически не применяются, поскольку имеются более информативные и менее опасные методики. Вместе с тем следует отметить, что существует так называемая методика эмбриоскопии, применяемая в I триместре беременности. Для ее проведения используется специальная гибкая волоконная оптика.
В табл. 29.1 суммированы данные о возможности пренатальной диагностики наследственной патологии.
Таблица 29.1. Пренатальная диагностика патологии плода