CD4 лимфоциты при ВИЧ инфекции. Развитие т- и в-лимфоцитов Т цитотоксические cd3 cd8 понижен
Общее количество Т-лимфоцитов (CD3) в крови
Общее количество Т-лимфоцитов в крови у взрослых в норме — 58—76 %, абсолютное количество — 1,1—1,7-10’/л.
Зрелые Т-лимфоциты «отвечают» за реакции клеточного иммунитета и осуществляют иммунологический надзор за антигенным гомеостазом в организме. Они образуются в костном мозге, а получают дифференцировку в вилочковой железе, где разделяются на эффек-торные (Т-лимфоциты-киллеры, Т-лимфоциты гиперчувствительности замедленного типа) и регуляторные (Т-лимфоциты-хелперы, Т-лимфоциты-супрессоры) клетки. В соответствии с этим Т-лимфоциты выполняют в организме две важные функции: эффекторную и регуля-торную. Эффекторная функция Т-лимфоцитов — специфическая цитотоксичность по отношению к чужеродным клеткам. Регуляторная функция (система Т-хелперы — Т-супрессоры) состоит в контроле за интенсивностью развития специфической реакции иммунной системы на чужеродные антигены. Снижение абсолютного количества Т-лимфоцитов в крови свидетельствует о недостаточности клеточного иммунитета, повышение — о гиперактивности иммунитета и наличии иммунопролиферативных заболеваний.
Развитие любого воспалительного процесса сопровождается практически на всем его протяжении снижением содержания Т-лимфоцитов. Это наблюдается при воспалениях самой разнообразной этиологии: различных инфекциях, неспецифических воспалительных процессах, при разрушении поврежденных тканей и клеток после операции, травмы, ожогов, инфаркта, разрушении клеток злокачественных опухолей, трофических разрушениях и т.д. Снижение количества Т-лимфоцитов определяется интенсивностью воспалительного процесса, однако такая закономерность наблюдается не всегда. Т-лимфоциты наиболее быстро из всех иммуно-компетентных клеток реагируют на начало воспалительного процесса. Эта реакция проявляется еще до развития клинической картины заболевания. Повышение количества Т-лимфоцитов в течение воспалительного процесса является благоприятным признаком, а высокий уровень Т-лимфоцитов при резко выраженных клинических проявлениях такого процесса, напротив, — неблагоприятный признак, указывающий на вялое течение воспалительного процесса с тенденцией к хронизации. Полное завершение воспалительного процесса сопровождается нормализацией количества Т-лимфоцитов. Повышение относительного количества Т-лимфоцитов не имеет для клиники большого значения. Однако увеличение абсолютного количества Т-лимфоцитов в крови очень важно для диагностики лейкозов. Заболевания и состояния, приводящие к изменению количества Т-лимфоцитов в крови, представлены в табл. 7.19.
Таблица 7.19. Заболевания и состояния, приводящие к изменению количества
Т-лимфоцитов (CD3) в крови
Т-лимфоциты-хелперы (CD4) в крови
Количество Т-лимфоцитов-хелперов в крови у взрослых в норме — 36—55 %, абсолютное
Количество — 0,4—1,110’/л-
Т-лимфоциты — помощники (индукторы) иммунного ответа, клетки, регулирующие силу иммунного ответа организма на чужеродный антиген, контролирующие постоянство внутренней среды организма (антигенный гомеостаз) и обусловливающие повышенную выработку антител. Увеличение количества Т-лимфоцитов-хелперов свидетельствует о гиперактивности иммунитета, снижение — об иммунологической недостаточности.
Ведущее значение в оценке состояния иммунной системы имеет соотношение Т-хелпе-ров и Т-супрессоров в периферической крови, так как от этого зависит интенсивность иммунного ответа. В норме цитотоксических клеток и антител должно вырабатываться столько, сколько их необходимо для выведения того или иного антигена. Недостаточная активность Т-супрессоров ведет к преобладанию влияния Т-хелперов, что способствует более сильному иммунному ответу (выраженной антителопродукции и/или длительной активации Т-эффек-торов). Избыточная активность Т-супрессоров, напротив, приводит к быстрому подавлению и абортивному течению иммунного ответа и даже явлениям иммунологической толерантности (иммунологический ответ на антиген не развивается). При сильном иммунном ответе возможно развитие аутоиммунных и аллергических процессов. Высокая функциональная активность Т-супрессоров при таком ответе не позволяет развиться адекватному иммунному ответу, в связи с чем в клинической картине иммунодефицитов преобладают инфекции и предрасположенность к злокачественному росту. Индекс CD4/CD8 1,5—2,5 соответствует нор-мергическому состоянию, более 2,5 — гиперактивности, менее 1,0 — иммунодефициту. При тяжелом течении воспалительного процесса соотношение CD4/CD8 может быть меньше 1. Принципиальное значение это соотношение имеет при оценке иммунной системы у больных СПИДом. При данном заболевании вирус иммунодефицита человека избирательно поражает и разрушает СО4-лимфоциты, в результате чего соотношение CD4/CD8 понижается дозначений, значительно меньше 1.
Повышение соотношения CD4/CD8 (до 3) нередко отмечается в острой фазе различных воспалительных заболеваний за счет повышения уровня Т-хелперов и снижения Т-супрессоров. В середине воспалительного заболевания отмечается медленное снижение Т-хелперов и повышение Т-супрессоров. При стихании воспалительного процесса эти показатели и их соотношение нормализуются. Повышение соотношения CD4/CD8 характерно практически для всех аутоиммунных заболеваний: гемолитической анемии, иммунной тромбоцитопении, тиреоидита Хашимото, пернициозной анемии, синдрома Гудпасчера, системной красной волчанки, ревматоидного артрита. Увеличение соотношения CD4/CD8 за счет снижения уровня CD8 при перечисленных заболеваниях выявляется обычно в разгаре обострения при большой активности процесса. Снижение соотношения CD4/CD8 вследствие роста уровня CD8 характерно для ряда опухолей, в частности саркомы Капоши. Заболевания и состояния, приводящие к изменению количества CD4 в крови, представлены в табл. 7.20.
Таблица 7.20. Заболевания и состояния, приводящие к изменению количества CD4 в крови
CD4 лимфоциты при ВИЧ инфекции. Развитие т- и в-лимфоцитов Т цитотоксические cd3 cd8 понижен

Отношение CD4:CD8 – что это, и что это значит для человека с ВИЧ-инфекцией
Соотношение Т-хелперов и Т-цитотоксических клеток называют иногда иммунорегуляторным индексом (ИРИ). Когда-то субпопуляцию CD3+CD8+ Т-лимфоцитов называли супрессорами – подавляющими иммунную систему – это была ошибка, их не существует, а данная субпопуляция сегодня относится к цитотоксическим лимфоцитам (клеткам-киллерам). CD4-лимфоциты называли хелперами –помогающими, стимулирующими, отсюда возникла гипотеза, что можно оценить подавление или стимуляцию иммунной системы, оценивая соотношение этих видов лимфоцитов. Впрочем, время показало, что все совсем не так – все куда более сложно, и трактовка в разрезе термина ИРИ и в ключе «стимуляция-подавление» – не имеет никакого смысла. Потому мы не будем говорить об ИРИ, а будем говорить именно о соотношении CD4-лимфоцитов к CD8 и исключительно в разрезе ВИЧ-инфекции.
Дифференцировку лейкоцитов с начала 80х годов прошлого века принято описывать по наличию различных CD-рецепторов на их поверхности. CD4 и CD8-рецепторы – это трансмембранные гликопротеины, названные по кодам кодирующих генов: первый кодируется геном CD4, второй – CD8.
Нас интересуют две субпопуляции в данном вопросе: Т-хелперы, которые экспрессируют на поверхности рецепторы CD45+, CD3+ и CD4+, и цитотоксические Т-лимфоциты, которые также несут свой специфический комплект рецепторов – CD45+, CD3+ и CD8+. В упрощенном виде лимфоциты можно называть соответственно CD4 и CD8.
Напомним, что вирус иммунодефицита человека для проникновения в клетку использует именно CD4-рецептор, T-хелперы обладают данным рецептором и страдают от ВИЧ. Не забываем, что тем же CD4-рецептором может обладать и ряд других клеток, например, моноциты, макрофаги, клетки микроглии, дендритные и некоторые другие.
Какое же значение имеет соотношение CD4 к CD8-клеткам? В общем случае у человека без ВИЧ изменения отражают фазы иммунного ответа на инфекционный агент. В острый период соотношение возрастает за счет увеличения доли и числа T-хелперов, а в период реконвалесценции нарастает уровень цитотоксических лимфоцитов, и соотношение падает. Вот эта фазность процессов может быть важна, ее иногда учитывают клиницисты.
При ВИЧ-инфекции история куда более запутанная — соотношение CD4 к CD8 обычно неуклонно падает с течением заболевания. В первые полгода-год инфекции в среднем CD4 могут снизиться на треть, а CD8 – вырасти на примерно ту же долю. С одной стороны, есть инфекционный агент, есть иммунный ответ, но с другой стороны, вирус непосредственно влияет негативно на уровень CD4-клеток. Потому принципы оценки соотношения CD4/CD8 не столь ясны, но все же некую информацию данное соотношение несет.
Некоторое время назад были даже попытки ставить диагноз ВИЧ-инфекции у младенцев в странах Африки по этому соотношению, но улучшение доступа к обычным методам диагностики позволило отказаться от использования столь косвенных параметров.
Статистически значимая связь снижения отношения CD4/CD8 для рисков различных неблагоприятных событий, не связанных со СПИД, была подтверждена группой под руководством Sergio Serrano-Villar в 2014 году. Медианное значение CD4/CD8 в контрольной группе составляло 0,7 (межквартильный размах 0,48-0,94) и сравнивалось с группой со значением 0,46 (0,31-0,68). Примечательно то, что соотношение CD4/CD8 позволяет оценивать риски для данного типа событий точнее, чем оценка надира уровня CD4-лимфоцитов или абсолютные, или относительные, значения уровня CD4-клеток.
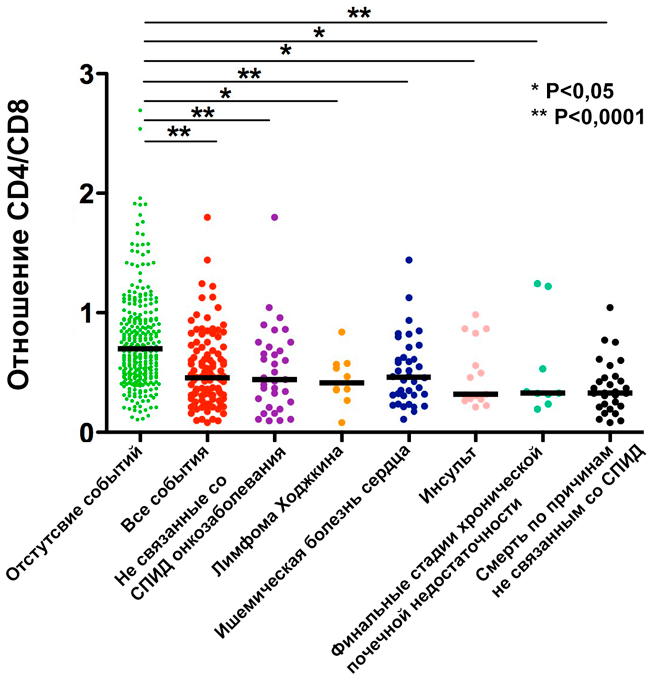 Адаптировано hiv.plus (Serano-Vilar и др., 2104)
Адаптировано hiv.plus (Serano-Vilar и др., 2104)
В других исследованиях (Ratnam и др., 2006) было показано, что это соотношение при значениях ниже 0,15 является независимым четким предиктором рисков возникновения воспалительного синдрома восстановления иммунитета (ВСВИ/IRIS), наряду с низким уровнем CD4 в абсолютном значении (менее 10%).
Субъекты с низким соотношением CD4/CD8, несмотря на успешную антиретровирусную терапию, могут представлять интерес для включения в клинические испытания, направленные на изучение аспектов снижения хронической иммунной активации.
Исследование большой канадской когорты (Mussini и др., 2015) показало, что при старте антиретровирусной терапии при медианном уровне 0,39 через год нормализация отношения CD4/CD8 наблюдалась лишь в 4,4% случаев, через два – 11,5%, а через пять лет – 29,4%.
Пожилой возраст и низкий надир (наиболее низкое наблюдаемое значение) уровня CD4 связаны с понижением шансов на нормализацию соотношения CD4 к CD8, а вот раннее начало терапии – значимо повышает эти шансы. Также было показано (Hurst J. и др., 2015), что динамика изменений отношения CD4 к CD8 хорошо отражает размер вирусного резервуара.
Каскад событий «иммунная активация», «истощение», «иммунное старение» также ведет к инверсии CD4/CD8. Старение Т-клеток следует понимать не буквально, а как комплекс изменений, таких как снижение экспрессии костимулирующих молекул (CD28), увеличение экспрессии ингибиторных структур (PD-1, CTLA-1), повышенная готовность к апоптозу (CD95, CD95L). Факторы, связанные со снижением CD4:CD8 у пациентов, получающих терапию ВИЧ-инфекции, схематично можно представить следующим образом:
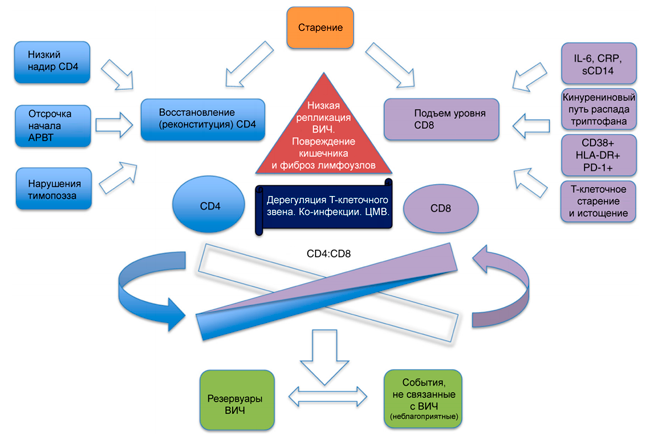 Адаптировано hiv.plus (Wei Lu и др., 2015)
Адаптировано hiv.plus (Wei Lu и др., 2015)
Итого: отношение CD4/CD8 является признанным биомаркером иммунной активации и иммунного старения, что при ВИЧ-инфекции находит свое подтверждении в увеличении рисков различных неблагоприятных событий, не связанных с ВИЧ. В клинической практике вряд ли сегодня возможно как-то явно и четко трактовать как абсолютные значения CD4/CD8, так и динамику этого отношения. Однако использование данного соотношения в рамках определенных клинических исследований, как показала практика, вполне оправдано.
- Serrano-Villar S, Pérez-Elías MJ, Dronda F. и др. Increased risk of serious non-AIDS-related events in HIV-infected subjects on antiretroviral therapy associated with a low CD4/CD8 ratio. PLoS One. 2014 Jan 30;9(1):e85798. PMID: 24497929.
- Ratnam I, Chiu C, Kandala NB, Easterbrook PJ. Incidence and risk factors for immune reconstitution inflammatory syndrome in an ethnically diverse HIV type 1-infected cohort. Clin Infect Dis. 2006 Feb 1;42(3):418-27. Epub 2005 Dec 28. PMID: 16392092.
- Hadrup SR, Strindhall J, Køllgaard T. и др. Longitudinal studies of clonally expanded CD8 T cells reveal a repertoire shrinkage predicting mortality and an increased number of dysfunctional cytomegalovirus-specific T cells in the very elderly. J Immunol. 2006 Feb 15;176(4):2645-53. PMID: 16456027.
- Bruno G, Saracino A, Monno L, Angarano G. The Revival of an “Old” Marker: CD4/CD8 Ratio. AIDS Rev. 2017 Apr – Jun;19(2):81-88. PMID: 28182620.
- Mussini C, Lorenzini P, Cozzi-Lepri A. и др. CD4/CD8 ratio normalisation and non-AIDS-related events in individuals with HIV who achieve viral load suppression with antiretroviral therapy: an observational cohort study. Lancet HIV. 2015 Mar;2(3):e98-106. PMID: 26424550.
- Saracino A, Bruno G, Scudeller L, Volpe A. и др. Chronic inflammation in a long-term cohort of HIV-infected patients according to the normalization of the CD4:CD8 ratio. AIDS Res Hum Retroviruses. 2014 Dec;30(12):1178-84.PMID: 25360575.
- Hurst J, Hoffmann M, Pace M. и др. Immunological biomarkers predict HIV-1 viral rebound after treatment interruption. Nat Commun. 2015 Oct 9;6:8495. PMID: 26449164.
- Lu W, Mehraj V, Vyboh K. и др. CD4:CD8 ratio as a frontier marker for clinical outcome, immune dysfunction and viral reservoir size in virologically suppressed HIV-positive patients. J Int AIDS Soc. 2015 Jun 29;18:20052. PMID: 26130226.
Оценка состояния Т-клеточного звена иммунитета: T-лимфоциты (CD3+CD19-), T-хелперы (CD3+CD4+CD45+), T-цитотокс. (CD3+CD8+CD45+), T-reg. (CD4+CD25brightCD45+), активированные (CD3+HLA-DR+CD38+)
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов ( T-reg. Cells) соотношения Т – хелперы/Т – цитотоксические клетки и Т-клеток, несущих на своей поверхности маркеры активации CD38, HLA-DR. Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторных лимфоциты.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Метод исследования
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование – характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
СD3
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
– первичные и вторичные иммунодефициты;
– острые вирусные инфекции, включая ВИЧ;
– внутриклеточные бактериальные и паразитарные инфекционные заболевания (например, туберкулез, лепра, лейшманиоз);
– реакции отторжения трансплантатов и болезни “трансплантат против хозяина”;
– лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
СD4
Использование МКА к CD4 антигену дает возможность количественно охарактеризовать особый клон клеток, получивших название Т-хелперов/индукторов. СD4+ клетки в функциональном отношении делятся на два вида хелперных лимфоцитов: Т-хелперы 1-го порядка (Th1-клетки) и 2-го порядка (Th2-клетки). Различные CD4+ Т-клетки продуцируют разные наборы цитокинов. Th1-клетки (их называют еще клетками гиперчувствительности замедленного типа – ГЗТ) – цитокины для клеточного иммунного ответа: интерлейкин 2 (IL-2), IL-3, g-IFN, TNF-a, TNF-b, – среди которых дискриминантным цитокином является g-IFN. Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа: IL-3, 4, 5, 6, 10, 13, TNF-b, – среди которых дискриминантным цитокином является IL-4.
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции и реакций клеточноопосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
СD8
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов:
- вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов);
- при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД;
- злокачественные новообразования;
- оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований считается, что существование какой-либо отдельной популяции Т-супрессорных клеток, даже без привязки к CD8-маркеру, маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Анти-HLA–DR
Молекула HLA-DR также является маркером активации и принадлежит к МНС II класса. Она представляет собой трансмембранный гликопротеин, состоящий из a- и b-субъединиц, имеющих молекулярный вес 36 и 27 кД. Анти-HLA-DR реагирует только с эпитопом HLA-DR и не имеет перекрестных реакций с молекулами HLA-DQ и HLA-DP. Он экспрессируется на В-лимфоцитах, моноцитах, макрофагах, активированных Т-лимфоцитах.
Имеются данные о том, что молекула HLA-DR экспрессируется примерно на 10 % Т-лимфоцитах ПК, однако при активации клеток митогеном количество и плотность ее экспрессии резко возрастает. Существует предположение, что молекула HLA-DR на Т-клетках может выступать в качестве рецептора, участвующего в трансдукции сигнала активированными Т-лимфоцитами. Это наводит на мысль о ее возможной роли в качестве “профессиональной” АПК, участвующей в поддержании иммунной памяти.
HLA-DR также может присутствовать на клетках эпителия тимуса, на клетках В-лимфоцит-зависимых полей селезенки и лимфатических узлов, В-клеточной лимфомы. Этот антиген имеет коэкспрессию с CD1а антигеном на клетках Лангерганса.
CD25
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
- Т-лимфоциты (CD3 + CD19 – );
- Т-хелперы/индукторы ( CD3 + CD4 + CD45 + );
- Т-цитотоксические лимфоциты (Т-ЦТЛ) ( CD3 + CD8 + CD45 + );
- соотношение Т-хелперы / Т-цитотоксические лимфоциты (CD3 + CD4 + / CD3 + CD8 + ).
малые клеточные популяции, а также изучить их функциональную активность:
- активированные Т-лимфоциты (CD3 +HLA–DR + CD45 + );
- регуляторные Т-хелперные клетки (CD4 +CD25brigCD45 + ), выполняющие иммуносупрессорную функцию
- активированные цитотоксические Т-лимфоциты (CD3 +CD8brightCD38 + ) (% от всех Т-лимфоцитов)
- активированные Т-лимфоциты, экспрессирующие a-цепь рецептора ИЛ-2 (CD3 +CD25 +CD45 + ).
Когда назначается исследование?
Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах: регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию “трансплантат против хозяина”. Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции (сепсис, гнойные менингиты).
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит;
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Что такое лимфоциты в анализе крови, норма и отклонения
Какова норма лимфоцитов в крови? Есть ли разница в их количестве у мужчин и женщин, детей и взрослых? Сейчас все расскажем. Уровень лимфоцитов в крови определяется в ходе общеклинических анализов с целью первичной диагностики наличия инфекционных заболеваний, аллергических реакций, а также при необходимости оценки побочных эффектов от лекарств и эффективности выбранного лечения.
Определение величины активированных лимфоцитов не является рутинным лабораторным исследованием и проводится исключительно при наличии показаний.
Данный анализ не выполняется отдельно от общего иммунологического обследования пациента или определения других лейкоцитарных клеток (эозинофилов, моноцитов, лимфоцитов в крови и т.д.) поскольку изолировано не имеет диагностической ценности.
Что такое лимфоциты в анализе крови?
Лимфоциты lymph – это белые кровяные клетки (разновидность лейкоцитов), посредствам которых реализуется защитная функция организма человека от чужеродных инфекционных агентов и собственных мутантных клеток.
Лимфоциты абс – это абсолютное число данного вида клеток, определяемое по формуле:
Общее количество лейкоцитов * Содержание лимфоцитов (%)/100
Активированные лимфоциты подразделяются на 3 субпопуляции:
- Т-лимфоциты – созревают в тимусе, ответственны за реализацию клеточного типа иммунного ответа (непосредственное взаимодействие иммунных клеток с патогенами). Они подразделяются на Т-хелперы (принимают участие в антигенпрезентации клеток, степени выраженности иммунной реакции и в синтезе цитокинов) и цитотоксические Т-лимфоциты (распознают чужеродные антигены и уничтожают их за счёт выброса токсинов или внедрения перфоринов, которые повреждают целостность цитоплазматической мембраны);
- В-лимфоциты — обеспечивают гуморальный иммунитет посредством выработки специфических белковых молекул – антител;
- NK-лимфоциты (натуральные киллеры) – растворяют клетки, зараженные вирусами или подвергшиеся злокачественному перерождению.
Известно, что лимфоциты в крови способны синтезировать на своей поверхности ряд антигенов, при этом, каждый из них уникален для своей субпопуляции и этапа формирования клетки. Функциональная активность подобных клеток различна. В большинстве случаев они являются мишенью для других лейкоцитов на этапе иммунофенотипирования.
Кластер дифференциации и его типы
Кластер дифференциации (cluster designation) – искусственно созданная номенклатура с присвоением номера различных антигенов, которые вырабатываются на поверхности лимфоцитов в крови. Синонимы термина: CD, CD-антиген или CD-маркер.
Во время лабораторной диагностики наличие меченых клеток в общей субпопуляции белых кровяных телец определяется при помощи моноклональных (одинаковых) антител с метками (на основе флюорохрома). При взаимодействии антител со строго специфичными CD-антигенами образуется устойчивый комплекс «антиген-антитело», при этом можно произвести подсчёт оставшихся свободными антител с меткой и определить количество лимфоцитов в крови.
Выделяют 6 типов кластеров CD-антигенов:
- 3 – характерен для Т-лимфоцитов, принимает участие в образовании комплекса передачи сигнала по мембране;
- 4 – идентифицируется на нескольких типах лейкоцитов, способствует облегчению процесса распознавания чужеродных антигенов при взаимодействии с MHC (главный комплекс гистосовестимости) 2 класса;
- 8 – представлен на поверхности цитотоксичных Т-, NK-клеток, функционал аналогичен предыдущему типу кластеров, только распознаются антигены связанные с MHC 1 класса;
- 16 – присутствует на различных видах белых кровяных телец, входит в состав рецепторов, отвечающих за активацию фагоцитоза и цитотоксичного ответа;
- 19 – компонент В-лимфоцитов, необходим для их правильной дифференциации и активации;
- 56 – вырабатывается на поверхности NK- и некоторых Т-клеток, необходим для обеспечения их прикрепления к тканям, поражённых злокачественными опухолями.
Показания к исследованию
Активированные лимфоциты в крови у ребёнка и взрослых определяются при:
- диагностике аутоиммунных заболеваний, онкопатологий, аллергических реакций и степени их выраженности;
- диагностике и контроле лечения острых инфекционных патологий;
- проведении дифференциальной диагностики вирусных и бактериальных инфекций;
- оценке состояния иммунной системы (в том числе и при наличии иммунодефицитов);
- оценке напряжённости иммунного ответа в случае наличия тяжёлых инфекций, ставших хроническими;
- комплексном обследовании до и после обширного хирургического вмешательства;
- подозрении на угнетение иммунного статуса, вызванного генетической мутацией;
- контроле степени напряжённости иммунитета на фоне приёма иммунодепрессанов или иммуностимуляторов.
Норма лимфоцитов в крови
Количество лимфоцитов в крови определяется при помощи проточной цитофлуориметрии, сроки исследования 2-3 суток без учёта дня взятия биоматериала. Важно грамотно интерпретировать полученные результаты, желательно приложение к иммунограмме заключения врача-иммунолога. Окончательный диагноз устанавливается по совокупности данных лабораторных и инструментальных методов обследования, а также клинической картины пациента.
Отмечено, что диагностическая ценность значительно возрастает при оценке напряжённости иммунитета у человека в динамике при регулярных повторных анализах.
Активированные лимфоциты в анализе крови у ребенка и взрослого отличаются, поэтому при расшифровке результатов следует подбирать нормальные (референсные) значения с учётом возраста пациента.
Таблица нормального диапазона лимфоцитов по возрасту
В таблице представлены величины допустимых норм лимфоцитов (отдельных субпопуляций) в крови у детей и взрослых.



