Механизмы действия гормонов. Гидрофильные гормоны, их строение и биологические функции Вторичные посредники гормонов в клетке
Механизм действия гидрофильных гормонов
Гидрофильные гормоны построены из аминокислот, или являются производными аминокислот. Они депонируются в больших количествах в клетках желез внутренней секреции и поступают в кровь по мере необходимости. Большинство этих веществ переносятся в кровотоке без участия переносчиков. Гидрофильные гормоны не способны проходить через липофильную клеточную мембрану, поэтому действуют на клетки-мишени за счет связывания с рецептором на плазматической мембране.
Рецепторы – это интегральные мембранные белки, которые связывают сигнальные вещества на внешней стороне мембраны и за счет изменения пространственной структуры генерируют новый сигнал на внутренней стороне мембраны.
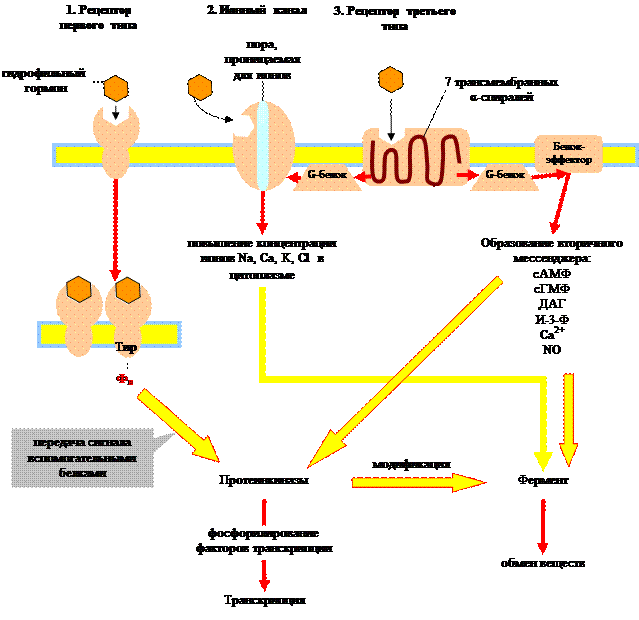
Различают три типа рецепторов:
- Рецепторы первого типа – это белки, которые имеют одну трансмембранную цепь. Активный центр этого аллостерического фермента (многие являются тирозиновыми протеинкиназами) расположен на внутренней стороне мембраны. При связывании гормона с рецептором происходит димеризация последнего с одновременной активизацией и фосфорилированием тирозина в рецепторе. С фосфотирозином связывается белок-переносчик сигнала, который передает сигнал внутриклеточным протеинкиназам.
- Ионные каналы.Это мембранные белки, которые при связывании с лигандами оказываются открытыми для ионов Na + , K + или Cl + . Так действуют нейромедиаторы.
- Рецепторы третьего типа, сопряжены с ГТФ-связывающими белками. Пептидная цепь этих рецепторов включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков (G-белок) на белки-эффекторы. Функция этих белков заключается в изменении концентрации вторичных мессенджеров(см. ниже).
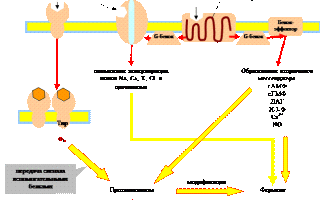
Связывание гидрофильного гормона с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: 1) рецепторные тирозинкиназы активируют внутриклеточные протеинкиназы, 2) активация ионных каналов ведет к изменению концентрации ионов, 3) активация рецепторов, сопряженных с ГТФ-связывающими белками, запускает синтез веществ-посредников, вторичных мессенджеров. Все три системы передачи гормонального сигнала взаимосвязаны.
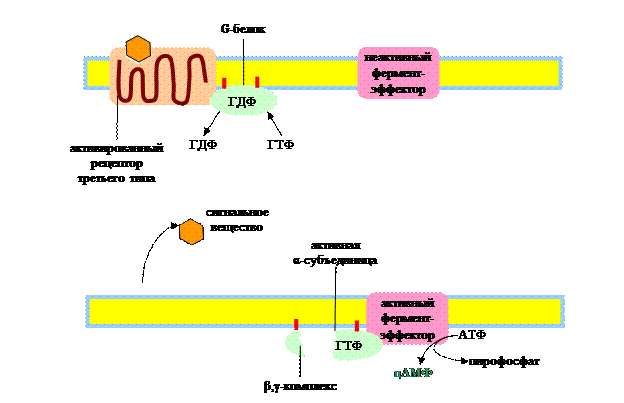
Рассмотрим преобразование сигнала G-белками, поскольку этот процесс играет ключевую роль в механизме действия целого ряда гормонов. G-белки переносят сигнал с рецептора третьего типа на белки-эффекторы. Они состоят из трех субъединиц: α, β и g. α-субъединица может связывать гуаниновые нуклеотиды (ГТФ, ГДФ). В неактивном состоянии G-белок связан с ГДФ. При связывании гормона с рецептором, последний меняет свою конформацию таким образом, что может связать G-белок. Соединение G-белка с рецептором приводит к обмену ГДФ на ГТФ. При этом происходит активация G-белка, он отделяется от рецептора и диссоциирует на α-субъединицу и β, g-комплекс. ГТФ-α-субъединица связывается с белками-эффекторами и изменяет их активность, в результате чего происходит синтез вторичных посредников (мессенджеров): цАМФ, цГМФ, диацилглицерин (ДАГ), инозит-1,4,5-трифосфат (И-3-Ф) и др. Медленный гидролиз связанного ГТФ до ГДФ переводит α-субъединицу в неактивное состояние и она вновь ассоциируется с β, g-комплексом, т.е. G-белок возвращается в исходное состояние.


Вторичные мессенджеры, или посредники, это внутриклеточные вещества, концентрация которых строго контролируется гормонами, нейромедиаторами и другими внеклеточными сигналами. Наиболее важными вторичными мессенджерами являются цАМФ, цГМФ, диацилглицерин (ДАГ), инозит-1,4,5-трифосфат (И-3-Ф), монооксид азота.
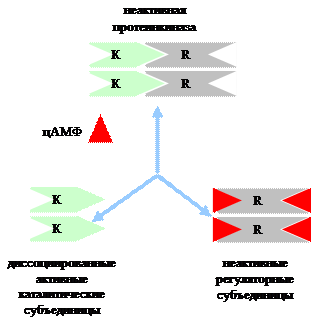
Механизм действия цАМФ. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-А) и ионных каналов. В неактивном состоянии ПК-А является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (R-субъединицы). При связывании цАМф R-субъединицы диссоциируют из комплекса и К-субъединицы активируются.
Активный фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.

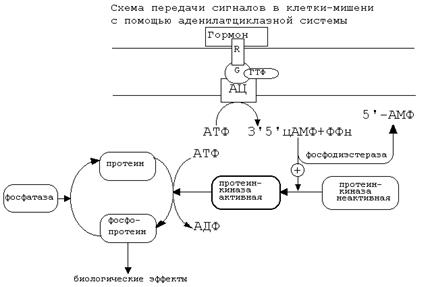
Если связать все воедино, то получается следующая схема аденилатциклазной системы:
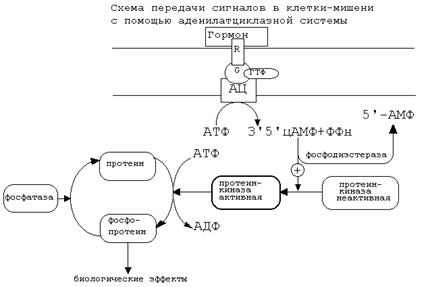
Активация аденилатциклазной систтемы длится очень короткое время, потому что G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу. В результате прекращается реакция образования цАМФ.
Кроме участников аденилатциклазной системы в некоторых клетках-мишенях имеются белки-рецепторы, связанные с G-белками, которые приводят к торможению аденилатциклазы. При этом комплекс “GTP-G-белок” ингибирует аденилатциклазу.
Когда останавливается образование цАМФ, реакции фосфорилирования в клетке прекращаются не сразу: пока продолжают существовать молекулы цАМФ – будет продолжаться и процесс активации протеинкиназ. Для того, чтобы прекратить действие цАМФ, в клетках существует специальный фермент – фосфодиэстераза, который катализирует реакцию гидролиза 3′,5′-цикло-АМФ до АМФ.
Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды кофеин, теофиллин), способствуют сохранению и увеличению концентрации цикло-АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, то есть усиливается действие гормона.
Кроме аденилат-циклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат – это вещество, которое является производным сложного липида – инозитфосфатида. Оно образуется в результате действия специального фермента – фосфолипазы “С”, который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.

Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок – кальмодулин. Это низкомолекулярный белок (17 кДа), на 30% состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са +2 . Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са +2 происходят конформационные изменения молекулы кальмодулина и комплекс “Са +2 -кальмодулин” становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты – аденилатциклазу, фосфодиэстеразу, Са +2 ,Мg +2 -АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса “Са +2 -кальмодулин” на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других – ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са +2 -кальмодулин будет отличаться.
Таким образом, в роли “вторых посредников” для передачи сигналов от гормонов в клетках-мишенях могут быть:
– Циклические нуклеотиды (ц-АМФ и ц-ГМФ);
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
1. одним из этапов передачи сигнала является фосфорилирование белков;
2. прекращение активации происходит в результате специальных механизмов, инициируемых самими участниками процессов, – существуют механизмы отрицательной обратной связи.
Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия.
Механизм действия гидрофильных гормонов
Гидрофильные гормоны построены из аминокислот, или являются производными аминокислот. Они депонируются в больших количествах в клетках желез внутренней секреции и поступают в кровь по мере необходимости. Большинство этих веществ переносятся в кровотоке без участия переносчиков. Гидрофильные гормоны не способны проходить через липофильную клеточную мембрану, поэтому действуют на клетки-мишени за счет связывания с рецептором на плазматической мембране.
Рецепторы – это интегральные мембранные белки, которые связывают сигнальные вещества на внешней стороне мембраны и за счет изменения пространственной структуры генерируют новый сигнал на внутренней стороне мембраны.
Различают три типа рецепторов:
- Рецепторы первого типа – это белки, которые имеют одну трансмембранную цепь. Активный центр этого аллостерического фермента (многие являются тирозиновыми протеинкиназами) расположен на внутренней стороне мембраны. При связывании гормона с рецептором происходит димеризация последнего с одновременной активизацией и фосфорилированием тирозина в рецепторе. С фосфотирозином связывается белок-переносчик сигнала, который передает сигнал внутриклеточным протеинкиназам.
- Ионные каналы.Это мембранные белки, которые при связывании с лигандами оказываются открытыми для ионов Na + , K + или Cl + . Так действуют нейромедиаторы.
- Рецепторы третьего типа, сопряжены с ГТФ-связывающими белками. Пептидная цепь этих рецепторов включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков (G-белок) на белки-эффекторы. Функция этих белков заключается в изменении концентрации вторичных мессенджеров(см. ниже).
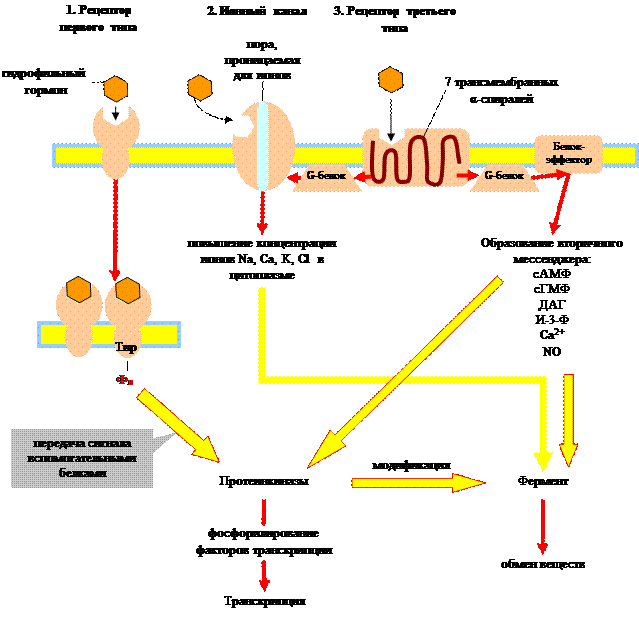
Связывание гидрофильного гормона с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: 1) рецепторные тирозинкиназы активируют внутриклеточные протеинкиназы, 2) активация ионных каналов ведет к изменению концентрации ионов, 3) активация рецепторов, сопряженных с ГТФ-связывающими белками, запускает синтез веществ-посредников, вторичных мессенджеров. Все три системы передачи гормонального сигнала взаимосвязаны.
Рассмотрим преобразование сигнала G-белками, поскольку этот процесс играет ключевую роль в механизме действия целого ряда гормонов. G-белки переносят сигнал с рецептора третьего типа на белки-эффекторы. Они состоят из трех субъединиц: α, β и g. α-субъединица может связывать гуаниновые нуклеотиды (ГТФ, ГДФ). В неактивном состоянии G-белок связан с ГДФ. При связывании гормона с рецептором, последний меняет свою конформацию таким образом, что может связать G-белок. Соединение G-белка с рецептором приводит к обмену ГДФ на ГТФ. При этом происходит активация G-белка, он отделяется от рецептора и диссоциирует на α-субъединицу и β, g-комплекс. ГТФ-α-субъединица связывается с белками-эффекторами и изменяет их активность, в результате чего происходит синтез вторичных посредников (мессенджеров): цАМФ, цГМФ, диацилглицерин (ДАГ), инозит-1,4,5-трифосфат (И-3-Ф) и др. Медленный гидролиз связанного ГТФ до ГДФ переводит α-субъединицу в неактивное состояние и она вновь ассоциируется с β, g-комплексом, т.е. G-белок возвращается в исходное состояние.

Вторичные мессенджеры, или посредники, это внутриклеточные вещества, концентрация которых строго контролируется гормонами, нейромедиаторами и другими внеклеточными сигналами. Наиболее важными вторичными мессенджерами являются цАМФ, цГМФ, диацилглицерин (ДАГ), инозит-1,4,5-трифосфат (И-3-Ф), монооксид азота.
Механизм действия цАМФ. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-А) и ионных каналов. В неактивном состоянии ПК-А является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (R-субъединицы). При связывании цАМф R-субъединицы диссоциируют из комплекса и К-субъединицы активируются.
Активный фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.
Если связать все воедино, то получается следующая схема аденилатциклазной системы:
Активация аденилатциклазной систтемы длится очень короткое время, потому что G-белок после связывания с аденилатциклазой начинает проявлять ГТФ-азную активность. После гидролиза ГТФ G-белок восстанавливает свою конформацию и перестает активировать аденилатциклазу. В результате прекращается реакция образования цАМФ.
Кроме участников аденилатциклазной системы в некоторых клетках-мишенях имеются белки-рецепторы, связанные с G-белками, которые приводят к торможению аденилатциклазы. При этом комплекс “GTP-G-белок” ингибирует аденилатциклазу.
Когда останавливается образование цАМФ, реакции фосфорилирования в клетке прекращаются не сразу: пока продолжают существовать молекулы цАМФ – будет продолжаться и процесс активации протеинкиназ. Для того, чтобы прекратить действие цАМФ, в клетках существует специальный фермент – фосфодиэстераза, который катализирует реакцию гидролиза 3′,5′-цикло-АМФ до АМФ.
Некоторые вещества, обладающие ингибирующим действием на фосфодиэстеразу, (например, алкалоиды кофеин, теофиллин), способствуют сохранению и увеличению концентрации цикло-АМФ в клетке. Под действием этих веществ в организме продолжительность активации аденилатциклазной системы становится больше, то есть усиливается действие гормона.
Кроме аденилат-циклазной или гуанилатциклазной систем существует также механизм передачи информации внутри клетки-мишени с участием ионов кальция и инозитолтрифосфата.
Инозитолтрифосфат – это вещество, которое является производным сложного липида – инозитфосфатида. Оно образуется в результате действия специального фермента – фосфолипазы “С”, который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора.
Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
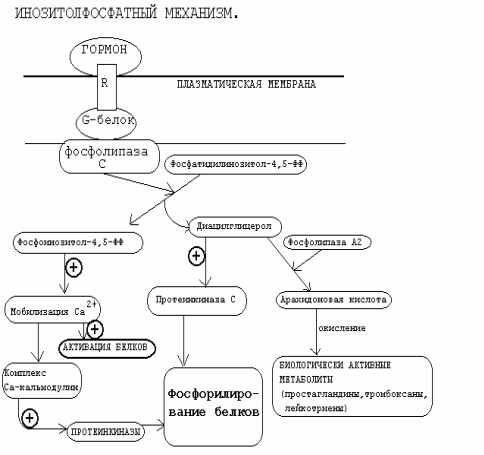
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона.
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок – кальмодулин. Это низкомолекулярный белок (17 кДа), на 30% состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са +2 . Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са +2 происходят конформационные изменения молекулы кальмодулина и комплекс “Са +2 -кальмодулин” становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты – аденилатциклазу, фосфодиэстеразу, Са +2 ,Мg +2 -АТФазу и различные протеинкиназы.
В разных клетках при воздействии комплекса “Са +2 -кальмодулин” на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других – ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са +2 -кальмодулин будет отличаться.
Таким образом, в роли “вторых посредников” для передачи сигналов от гормонов в клетках-мишенях могут быть:
– Циклические нуклеотиды (ц-АМФ и ц-ГМФ);
Механизмы передачи информации от гормонов внутри клеток-мишеней с помощью перечисленных посредников имеют общие черты:
1. одним из этапов передачи сигнала является фосфорилирование белков;
2. прекращение активации происходит в результате специальных механизмов, инициируемых самими участниками процессов, – существуют механизмы отрицательной обратной связи.
Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия.
Дата добавления: 2016-11-28 ; просмотров: 2656 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Механизм действия гидрофильных гормонов
Большинство гидрофильных сигнальных веществ не способны проходить через липофильную клеточную мембрану. Поэтому передача сигнала в клетку осуществляется через мембранные рецепторы (проводники сигнала). Рецепторы – это интегральные мембранные белки, которые связывают сигнальные вещества на внешней стороне мембраны и за счет изменения пространственной структуры генерируют новый сигнал на внутренней стороне мембраны. Данным сигналом определяется транскрипция определенных генов и активность ферментов, которые контролируют обмен веществ и взаимодействуют с цитоскелетом.
Различают три типа рецепторов.
1. Рецепторы первого типа являются белками, имеющими одну трансмембранную полипептидную цепь. Это аллостерические ферменты, активный центр которых расположен на внутренней стороне мембраны. Многие из них являются тирозиновыми протеинкиназами. К этому типу принадлежат рецепторы инсулина, ростовых факторов и цитокинов.
Связывание сигнального вещества ведет к димеризации рецептора. При этом происходит активация фермента и фосфорилирование остатков тирозина в ряде белков. В первую очередь фосфорилируется молекула рецептора (автофосфорилирование). С фосфотирозином связывается SН2-домен белка-переносчика сигнала, функция которого состоит в передаче сигнала внутриклеточным протеинкиназам.
2. Ионные каналы. Эти рецепторы второго типа являются олигомерными мембранными белками, образующими лиганд-активируемый ионный канал. Связывание лиганда ведет к открыванию канала для ионов Na+, К+ или Cl-. По такому механизму осуществляется действие нейромедиаторов, таких, как ацетилхолин (никотиновые рецепторы: Na+ – и К+-каналы) и г-аминомасляная кислота (А-рецептор: Cl–канал).
3. Рецепторы третьего типа, сопряженные с ГТФ – связывающими белками. Полипептидная цепь этих белков включает семь трансмембранных тяжей. Такие рецепторы передают сигнал с помощью ГТФ-связывающих белков на белки-эффекторы, которые являются сопряженными ферментами или ионными каналами. Функция этих белков заключается в изменении концентрации ионов или вторичных мессенджеров.
Таким образом, связывание сигнального вещества с мембранным рецептором влечет за собой один из трех вариантов внутриклеточного ответа: рецепторные тирозинкиназы активируют внутриклеточные протеинкиназы, активация лиганд-активируемых ионных каналов ведет к изменению концентрации ионов и активация рецепторов, сопряженных с ГТФ-связывающими белками, индуцирует синтез веществ-посредников, вторичных мессенджеров. Все три системы передачи сигнала взаимосвязаны. Так, например, образование вторичного мессенджера цАМФ (сАМР) приводит к активации протеинкиназ А [ПК-А (PK-A)], вторичный мессенджер диацилглицерин [ДАГ (DAG)] активирует [ПК-С (PK-C)], а вторичный мессенджер инозит-1,4,5-трифосфат [ИФ3 (InsP3)] вызывает повышение концентрации ионов Са2+ в цитоплазме клетки.
Преобразование сигнала G-белками.
G-белки (англ. G proteins) – это семейство белков, относящихся к ГТФазам и функционирующих в качестве вторичных посредников во внутриклеточных сигнальных каскадах. G-белки названы так, поскольку в своём сигнальном механизме они используют замену GDP на GTP как молекулярный функциональный “выключатель” для регулировки клеточных процессов.
G-белки переносят сигнал с рецептора третьего типа на белки-эффекторы. Они построены из трех субъединиц: б, в и г. б-cубъединица обладает свойством связывать гуаниновые нуклеотиды [ГТФ (GTP) или ГДФ (GDP)]. Белок проявляет слабую ГТФ-азную активность и похож на другие ГТФ-связывающие белки, такие, как ras и фактор элонгации Tu (EF-Tu). В неактивном состоянии G-белок связан с ГДФ.
При связывании сигнального вещества с рецептором третьего типа конформация последнего изменяется таким образом, что комплекс приобретает способность связывать G-белок. Ассоциация G-белка с рецептором приводит к обмену ГДФ на ГТФ (1). При этом происходит активация G-белка, он отделяется от рецептора и диссоциирует на б-субъединицу и в,г-комплекс. ГФЦ-б субъединица связывается с белками-эффекторами и изменяет их активность, в результате чего происходит открывание или закрывание ионных каналов, активация или ингибирование ферментов (2). Медленный гидролиз связанного ГТФ до ГДФ переводит б-субъединицу в неактивное состояние и она вновь ассоциирует с в,г-комплексом, т.е. G-белок возвращается в исходное состояние. [ 1 ]
Механизмы действия гормонов на клетки
Существуют 2 основных механизма действия гормонов на уровне клетки: реализация эффекта с наружной поверхности клеточной мембраны («быстрые» эффекты) и реализация эффекта после проникновения гормона внутрь клетки («медленные» эффекты).
С помощью первого механизма действуют гидрофильные гормоны(гистамин, адреналин,инсулин, глюкагон), которые не могут непосредственно проникать через биологические мембраны внутрь клетки (т.к. это в основном белки). Они взаимодействуют с рецепторами, встроенными в мембрану клетки, а передача сигнала к внутриклеточным структурам осуществляется вторичными посредниками, или мессенджерами. Первичным мессенджером чаще всего является G-белок мембраны. Активированный G-белок взаимодействует с одним или несколькими вторичными мессенджерами, способными фосфорилировать строго определенные белки. Такая химическая модификация белка меняет его конфигурацию. В итоге в одних случаях активность белка в результате фосфорилирования повышается, в других – снижается. Это обусловливает конечный ответ клетки, например, изменяется активность соответствующих ферментов или структурных белков. Характерной особенностью такого механизма является относительная быстрота возникновения ответной реакции.
Гидрофобные гормоны(стероидные и тиреоидные), которые в силу своей липофильности легко проникают через мембрану внутрь клетки-мишени, связываются в ее цитоплазме со специфическими белками-рецепторами. Гормонрецепторный комплекс проникает в клеточное ядро, где он влияет на активность тех или иных генов, в соответствующих участках ДНК. Причем активность одних генов может возрастать, а других в этой же клетке – уменьшаться. В соответствии с этим усиливается или, напротив, тормозится синтез определенного белка. Так действуют стероидные гормоны. Производные тирозина – гормоны щитовидной железы могут проходить не только в клетку, но и в само ядро, связываясь с ядерными рецепторами. Для гормонов такого типа действия характерна глубокая и длительная перестройка клеточного метаболизма.

Продолжительность жизни гормонов
Время действия гормонов характеризуется периодом полураспада, необходимым для расщепления и инактивирования половины имеющегося гормона (табл. 5).
Таблица 5
Период полураспада действия гормонов
Латентный период — время от момента рецепции гормонального сигнала до появления специфической клеточной реакции также различно — от нескольких секунд до нескольких суток и может быть представлено в нарастающей последовательности: пептиды — секунды-минуты; белки и гликопротеины — минуты-часы; стероиды — часы; йодсодержащие гормоны — сутки.
Например, коротколатентным действием обладает адреналин, который изменяет активность предсуществующих, т.е. ранее синтезированных, ферментов — регуляторов распада и синтеза гликогена в печени; длительным латентным периодом характеризуется действие половых стероидных гормонов, направленное на геном клетки, связанное с образованием специфических клеточных белков, используемых в пластических анаболических процессах.
В целом время «жизни» гормона определяется его химической природой, типом гормонрецепторного взаимодействия, механизмами трансмембранного проведения и внутриклеточного усиления сигнала. Во многих отношениях эти процессы еще остаются нераскрытыми.
Распад гормонов осуществляется в различных органах, выполняющих функцию биологической трансформации,— печени, почках, легких, мозге — существуют ферментные системы, инактивирующие и расщепляющие «отработанные» белковые и пептидные гормоны. Часть гормонов разрушается в плазме крови, многие выводятся из организма с мочой в неизменном виде.Некоторые гормоны после взаимодействия с рецептором подвергаются внутриклеточной деградации; распад гормонрецепторных комплексов или гормона после его отщепления от рецептора происходит в лизосомах.
Регуляция секреции гормонов
Регуляция функций желез внутренней секреции осуществляется несколькими взаимосвязанными механизмами: внутриклеточным, гуморальным и нервным.
Внутриклеточная регуляция реализуется с помощью рецепторов гормонов, G-белков, циклических нуклеотидов, ферментов, Ca 2+ и других вторых посредников синтеза и секреции гормонов, наконец, с участием генома. Гены задают тип синтезируемого в клетке гормона, тогда как другие гормоны являются регуляторами генов.
Гуморальные факторы регуляции– это действие метаболитов и гормонов.
Непосредственное регулирующее действие на железы внутренней секреции оказывают некоторые негормональные метаболиты — глюкоза, свободные жирные кислоты, аминокислоты, монооксид азота, а также некоторые ионы (НСОз – , Н + , Na + , Ca 2+ , K + и др.).

При этом регулирующий метаболит может действовать как стимулятор функций железы, если гормон этой железы снижает концентрацию данного метаболита. Однако регулирующий метаболит может действовать и как ингибитор функции железы, если ее гормон увеличивает концентрацию данного метаболита.
Гормональная регуляцияпроявляется во взаимодействиях некоторых гормонов между собой (см. выше).

Нервная регуляцияпредставлена сложной совокупностью центральных механизмов, среди которых главная роль принадлежит гипоталамо-гипофизарной системе (подробнее – см. в разделе «Частная физиология нервной системы»).


Вегетативная нервная система оказывает как прямое, так и опосредованное действие на секреторную активность желез внутренней секреции через изменение кровотока и активности миоэпителиальных клеток, окружающих железы.
Рефлекторные реакции желез внутренней секреции возникают в ответ на возбуждение рецепторов сердца, сосудов, желудочно-кишечного тракта, печени, желчного пузыря, поджелудочной железы, почек и других внутренних органов, а также рецепторов самих желез внутренней секреции. В последнем случае чувствительные нервы желез внутренней секреции передают в ЦНС информацию об уровне их функциональной активности.
Способностью прямо преобразовывать симпатические нервные импульсы в гуморальные факторы регуляции обладают: хромаффинные клетки мозгового вещества надпочечников; гипоталамические нейросекреторные клетки; эпифиз; панкреатические островки; юкстагломерулярные клетки.
Функции парасимпатических нервных волокон, проникающих в щитовидную, паращитовидные, половые железы и надпочечники, до сих пор не ясны.
Дата добавления: 2018-02-28 ; просмотров: 360 ;