Микробиом кишечника: мир внутри нас. Иммунная система кишечника и ее взаимодействие с микрофлорой Молекулярные механизмы гистогенеза Пейровых бляшек
Микробиом кишечника: мир внутри нас. Иммунная система кишечника и ее взаимодействие с микрофлорой Молекулярные механизмы гистогенеза Пейровых бляшек

Желудочно-кишечный тракт представляет собой самый обширный ареал обитания микрофлоры в организме, поскольку площадь его поверхности составляет более 300 м 2 . Биоценоз кишечника является открытым, то есть, микробы извне легко могут попадать туда с пищей и водой. Для поддержания относительного постоянства внутренней среды пищеварительный тракт обладает мощными механизмами антимикробной защиты, основными из которых являются желудочный кислотный барьер, активная моторика и иммунитет.
Иммунная система слизистых оболочек является частью общей иммунной системы организма и в то же время отличается определенной автономностью. Главной ее задачей является обеспечение эффективного защитного барьера на границе соприкосновения внешней среды, изобилующей различными антигенами, как живыми (вирусами, бактериями, паразитами и т.д.), так и неживыми (токсинами, ядами, пищевыми антигенами и т.д.), и внутренней среды организма, сохраняющей относительное постоянство. Поскольку поверхность этого соприкосновения в ЖКТ во много раз превосходит все другие открытые поверхности организма (например, поверхность кожи составляет 2м 2 , а поверхность легких — 80м 2 ), кишечник должен обладать самыми мощными системами защиты. Действительно, кишечник является самым большим иммунным органом человеческого организма:
- Около 80% всех иммунокомпетентных клеток организма локализовано в слизистой оболочке кишечника (СОК)
- Около 25% СОК состоит из иммунологически активной ткани и клеток
- Каждый метр кишечника взрослого человека содержит около 10 10 лимфоцитов.
- Морфологически иммунная система кишечника (GALT — gut associated lymphoid tissue) включает:
Клеточные элементы:
Структурные элементы:
Структурные элементы GALT-системы осуществляют адаптивный иммунный ответ, сущность которого во взаимодействии между антиген-презентирующими клетками (АПК) и Т-лимфоцитами, что контролируется клетками иммунологической памяти.
Защитный слизистый барьер включает не только иммунные, но и не иммунные факторы: непрерывный слой цилиндрического эпителия с тесным соприкосновением клеток друг с другом, покрывающий эпителий гликокаликс, ферменты мембранного пищеварения, а также связанную с поверхностью эпителия мембранную флору (М-флору). Последняя посредством гликоконъюгированных рецепторов соединяется с поверхностными структурами эпителия, усиливая выработку слизи и уплотняя цитоскелет эпителиоцитов.
Тоll-подобные рецепторы (Тоll-like-receptors – TLR) относятся к элементам врожденной иммунной защиты кишечного эпителия, распознающим “своих” от “чужих”. Они представляют собой трансмембранные молекулы, связывающие экстра- и интрацеллюлярные структуры. Идентифицировано 11 типов TLR. Они способны распознавать определенные паттерны молекул антигенов кишечных бактерий и связывать их. Так, TLR-4 является главным сигнальным рецептором для липополисахаридов (ЛПС) Грам(-) бактерий, термических шоковых протеинов и фибронектина, TLR-1,2,6 — липопротеинов и ЛПС Грам(+) бактерий, липотейхоевых кислот и пептидогликанов, TLR-3 — вирусной РНК. Эти TLR находятся на апикальной мембране кишечного эпителия и связывают антигены на поверхности эпителия. При этом внутренняя часть TLR может служить рецептором для цитокинов, например, IL-1, IL-14. TLR-5 находится на базолатеральной мембране эпителиальной клетки и распознает флагеллины энтероинвазивных бактерий, которые уже проникли внутрь эпителия.
TLR-рецепторы в ЖКТ обеспечивают:
- Толерантность к индигенной флоре
- Снижение вероятности аллергических реакций
- Доставку антигена антигенпрезентирующим клеткам (АПК)
- Повышение плотности межклеточных соединений
- Индукцию антимикробных пептидов
Антимикробные пептиды секретируются как циркулирующими клетками, так и клетками эпителия ЖКТ и являются неспецифическими факторами гуморальной иммунной защиты. Они могут быть различны по структуре и функции. Крупные белки выполняют функцию протеолитических ферментов, лизируя клетки, а мелкие нарушают структуру мембран, образуя бреши с последующей потерей из пораженной клетки энергии и ионов и последующим лизисом. У человека главными классами антимикробных пептидов являются кателицидины и дефенсины, среди последних различают альфа- и бета-дефенсины.
Дефенсины – это мелкие катионные пептиды, в нейтрофилах они участвуют в кислород-независимом уничтожении фагоцитированных микробов. В кишечнике они контролируют процессы прикрепления и проникновения микробов. Бета-дефенсины отличаются индивидуальной вариабельностью и представлены практически во всех отделах ЖКТ, поджелудочной и слюнных железах. Они соединяются с дендритными клетками, которые экспрессируют хемокиновый рецептор и регулируют хемотаксис дендритных клеток и Т-клеток. В результате дефенсины принимают участие в адаптивной фазе иммунного ответа. Дефенсины могут стимулировать продукцию IL-8 и хемотаксис нейтрофилов, вызывать дегрануляцию тучных клеток. Они также тормозят фибринолиз, который способствует распространению инфекции, альфа-дефенсины HD-5 и НD-6 обнаружены в клетках Панета в глубине крипт тонкой кишки. Экспрессия НD-5 усиливается при любом воспалении кишки, а НD-6 — только при воспалительных заболеваниях кишечника, альфа-дефенсин hBD-1 представляет собой основную защиту кишечного эпителия, предупреждая прикрепление микроорганизмов в отсутствие воспаления. Экспрессия hBD-2 представляет собой реакцию на воспалительные и и инфекционные стимулы.
У человека выделен только один кателицидин — LL-37/hСАР-18, он обнаружен в верхней части крипт толстой кишки. Усиление экспрессии его наблюдается при некоторых кишечных инфекциях, он обладает бактерицидным действием.
Кишечный эпителий выполняет не только барьерную функцию, но и обеспечивает поступление в организм питательных веществ, витаминов, микроэлементов, солей и воды, а также антигенов. Слизистый барьер не представляет собой абсолютно непреодолимого препятствия, он является высокоселективным фильтром, обеспечивающим контролируемый физиологический транспорт частиц через “эпителиальные отверстия”, тем самым может осуществляться персорбция частиц размером до 150 ммк. Вторым механизмом поступления антигенов из просвета кишки является их транспортировка через М-клетки, которые расположены над Пейеровыми бляшками, не имеют микроворсинок, но имеют микроскладочки (М-microfolds). Путем эндоцитоза они транспортируют макромолекулы через клетку, в процессе транспортировки происходит обнажение антигенных структур вещества, на базолатеральной мембране происходит стимуляция дендритных клеток, и в верхней части Пейеровой бляшки антиген презентируется Т-лимфоцитам. Антигены, презентируемые Т-хелперам и макрофагам, распознаются и, в случае наличия на поверхности клеток соответствующих антигену рецепторов, Th0-клетки трансформируются в Th1 или в Th2. Трансформация в Th1 сопровождается выработкой, так называемых, провоспалительных цитокинов: IL-1, ТNF-α, IFN-γ, активизацией фагоцитоза, миграцией нейтрофилов, усилением окислительных реакций, синтезом IgА, все эти реакции направлены на элиминацию антигена. Дифференцировка в Th2 способствует выработке противовоспалительных цитокинов: IL-4, IL-5, IL-10, обычно сопровождает хроническую фазу воспаления с выработкой IgG, а также способствует образованию IgЕ с развитием атопии.
В-лимфоциты в процессе ответа GALT-системы трансформируются в плазматические клетки и выходят из кишечника в мезентериальные лимфоузлы, а оттуда через грудной лимфатический проток — в кровь. С кровью они разносятся в слизистые оболочки различных органов: ротовой полости, бронхов, мочеполовых путей, а также в молочные железы. 80% лимфоцитов возвращается обратно в кишечник, этот процесс носит название homing.
У взрослых в желудочно-кишечном тракте обнаруживаются иммуноглобулины всех классов. В тощей кишке на 1 мм 3 ткани приходится 350 000 клеток, секретирующих IgА, 50 000 – секретирующих IgМ, 15 000 – IgG, 3000 – IgD, соотношение клеток, продуцирующих Ig А, М и G составляет 20:3:1. Стенка кишечника способна синтезировать до 3 г иммуноглобулинов в день, причем корреляции между содержанием их в плазме и кишечном соке не существует. В норме преобладающим среди классов иммуноглобулинов в кишечнике является секреторный IgА (SIgА). Он играет основную роль в специфической гуморальной защите слизистой оболочки, как ковром покрывая последнюю и препятствуя присоединению микробов к эпителию, нейтрализуя вирусы, задерживая проникновение в кровь растворимых антигенов. Интересно, что М-клетки захватывают преимущественно антигены в комплексе с IgА с последующей стимуляцией продукции IgА. SIgА, который синтезируется в форме димера, хорошо приспособлен к функционированию в кишечнике — он резистентен к воздействию протеолитических ферментов. В отличие от IgG, основного системного иммуноглобулина, SIgА не является спутником воспаления. Он связывает антигены на поверхности слизистой оболочки, препятствуя проникновению их внутрь организма и тем самым предотвращая развитие воспаления.
Главной функцией GALT-системы является распознавание и устранение антигенов или формирование иммунологической толерантности к ним. Формирование иммунологической толерантности является важнейшим условием существования ЖКТ как барьера на границе внешней и внутренней среды. Поскольку и пища, и нормальная кишечная микрофлора являются антигенами, они не должны восприниматься организмом как нечто враждебное и отторгаться им, они не должны вызывать развития воспалительного ответа. Иммунологическая толерантность к пище и облигатной кишечной микрофлоре обеспечивается через супрессию Th1 интерлейкинами IL-4, IL-10 и стимуляцию Th3 с продукцией ТGF-β при условии поступления низких концентраций антигена. Высокие дозы антигена вызывают клональную анергию, при этом Т-лимфоциты становятся не способными реагировать на стимуляцию и секретировать IL-2 или пролиферировать. ТGF-β представляет собой неспецифичный мощный супрессорный фактор. Возможно, формирование оральной толерантности к одному антигену способствует подавлению иммунного ответа и к другим. ТGF-β способствует переключению синтеза иммуноглобулинов с IgМ на IgА. Иммунологическая толерантность обеспечивается также синтезом Тоll-ингибирующего белка (Тоllip) и связанным с ним снижением экспрессии ТLR-2.
Эффективность работы GALT-системы зависит от заселения кишечника индигенной микрофлорой. Для осуществления взаимодействия между ними М-клетки слизистой оболочки кишечника перманентно транспортируют микробные антигены и презентируют их лимфоцитам, индуцируя их трансформацию в плазмоциты и homing. С помощью этого механизма осуществляется контролируемое противостояние чужеродному для организма антигенному материалу и собственной микрофлоре и сосуществование с ней. Наглядным примером огромного значения, которое имеет физиологическая микрофлора, служат результаты исследований на животных, выращенных в стерильных условиях – гнотобионтах. В отсутствии микробов у млекопитающих отмечено низкое количество Пейеровых бляшек и более чем 10-кратное снижение В-лимфоцитов, продуцирующих IgА. Количество гранулоцитов у таких животных было снижено, а имеющиеся гранулоциты были не способны к фагоцитозу, лимфоидные структуры организма оставались рудиментарными. После имплантации стерильным животным представителей нормальной кишечной флоры (лактобацилл, бифидобактерий, энтерококков) у них происходило развитие иммунных структур GALT. То есть, иммунная система кишечника созревает в результате взаимодействия с кишечной микрофлорой. Эта экспериментальная модель отражает нормальные онтогенетические процессы параллельного становления биоценоза и иммунной системы кишечника у новорожденных.
За последние десятилетия в индустриальных странах отмечается значительный рост аллергических заболеваний. Существует гипотеза, что он связан со снижением воздействия микробных антигенов в результате возросшей гигиены и активной вакцинации. Вероятно, снижение стимулирующего воздействия бактериальных антигенов переключает дифференцировку Th-лимфоцитов с Th1 (с выработкой IL-6, IL-12, IL-18, IFN-γ и IgА) преимущественно на Th2 (с выработкой IL-4, IL-10 и IgG и IgЕ). Это может способствовать формированию пищевой аллергии.
Микробиом кишечника: мир внутри нас. Иммунная система кишечника и ее взаимодействие с микрофлорой Молекулярные механизмы гистогенеза Пейровых бляшек
Многие общие закономерности иммунитета слизистых оболочек были выявлены и детально изучены на примере кишечного иммунитета. По массе иммунокомпетентных клеток кишечнику принадлежит ведущее место в иммунной системе слизистых покровов, и в этом отношении он значительно превосходит иммунную систему респираторного тракта.
Кишечник — важный иммунологический орган, в собственной пластике (lamina propria) которого содержится столько же лимфоидных клеток, сколько в селезенке. Среди этих клеток идентифицированы Т-, В-клетки, малые лимфоциты и плазматические клетки. Последние синтезируют иммуноглобулины преимущественно класса А и являются источником антител, секретируемых слизистой оболочкой кишечника. Многочисленные малые лимфоциты контролируют выработку антител и, кроме того, осуществляют реакции клеточного иммунитета. Иммунологическая функция кишечника опосредована действием, прежде всего, лимфоцитов, расположенных в пейеровых бляшках и в слизистой оболочке. Популяция лимфоцитов пейеровых бляшек состоит из предшественников В-(80%) и Т-(20%) клеток.
Лимфоциты эпителиального слоя кишечной стенки представлены исключительно Т-клетками, тогда как в подслизистом слое преобладают В-клетки, большинство из которых синтезируют IgA. Исключение составляют жвачные животные, у которых в подслизистом слое преобладают IgG, продуцирующие клетки.
Иммунитет против энтеропатогенных агентов в основном осуществляется посредством антител, секретируемых в просвет кишечника. Антитела, защищающие слизистую оболочку кишечника, могут поступать из двух источников: из сыворотки крови и плазматических клеток, расположенных в lamina propria. Сывороточные антитела, очевидно, менее эффективны, поскольку достаточное для местной защиты количество их накапливается в кишечнике только при наличии высоких уровней в сыворотке крови. Сывороточные антитела, участвующие в создании местного иммунитета, проникают в просвет кишечника в результате экссудации и относятся преимущественно к классу IgG.
Защитный эффект при гриппе обеспечивается главным образом продукцией циркулирующих антител и других факторов системного иммунитета, которые защищают от инфекции легкие, но слабо ограничивают размножение вируса в верхней части респираторного тракта. Подобным образом циркулирующие антитела (IgG) могут переноситься из крови в желудочно-кишечный тракт и защищать телят от ротавирусной инфекции.
Однако антитела, синтезируемые местно плазматическими клетками кишечника, обычно относятся к IgA и в силу устойчивости к протеолитическим ферментам в большей степени приспособлены к защите поверхности слизистой оболочки, чем IgG. Иммунная система кишечника во многом функционирует независимо от системных иммунных механизмов. Это прежде всего относится к иммунной системе кишечника свиней. Антигенная стимуляция В- и Т-клеток происходит в пейеровых бляшках, представленных отдельными скоплениями лимфоидных клеток, расположенных в подслизистом слое тонкого отдела кишечника.
Эпителий слизистой оболочки кишечника, покрывающий пейеровы бляшки, видоизменен: он образует лишь рудиментные ворсинки и обладает повышенной способностью к пиноцитозу Эти эпителиальные клетки обладают специализированной функцией «захвата» антигена из просвета кишечника и представляют его лимфоидным элементам бляшек. Они утратили характерную цилиндрическую форму, содержат много цитоплазматических вакуолей и называются мембранными или М-клетками, так как имеют микроскладки.
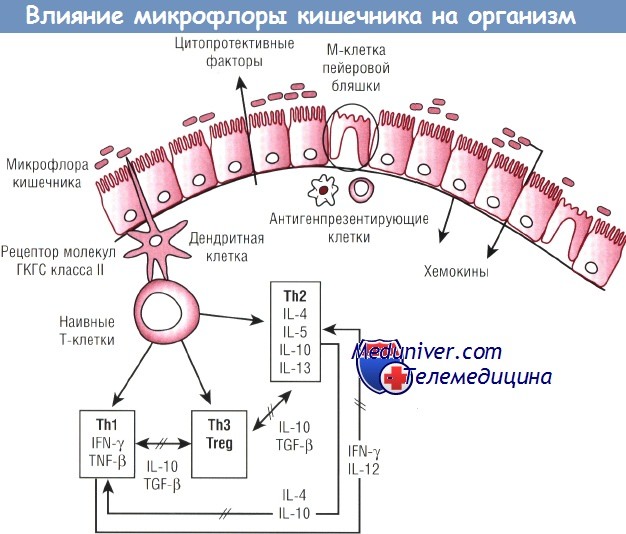 Эпителий кишечника способен распознавать микроорганизмы благодаря наличию трех типов клеток: дендритных клеток, М-клеток пейеровых бляшек и эпителиальных клеток кишечника. Взаимодействие с бактериями может обусловить возникновение иммунных Th1- и Th2-ответов, которые удерживаются в равновесии благодаря цитокинам и регуляторным Т-клеткам (Treg). Кроме того, воздействие бактерий может привести к продукции как хемокинов, так и цитопротективных факторов.
Эпителий кишечника способен распознавать микроорганизмы благодаря наличию трех типов клеток: дендритных клеток, М-клеток пейеровых бляшек и эпителиальных клеток кишечника. Взаимодействие с бактериями может обусловить возникновение иммунных Th1- и Th2-ответов, которые удерживаются в равновесии благодаря цитокинам и регуляторным Т-клеткам (Treg). Кроме того, воздействие бактерий может привести к продукции как хемокинов, так и цитопротективных факторов.
IFN — интерферон;
IL — интерлейкин;
TCF — трансформирующий фактор роста;
Th — Т-хелперы;
TNF — фактор некроза опухоли;
ГКГС — главный комплекс гистосовместимости
Частота формирования ротавирусспецифичных Тц-лимфоцитов в пейеровых бляшках после перорального инфицирования в 25—30 раз превышала частоту образования соответствующих клеток после инокуляции вируса в лапу мышей. Эффективность энтеральной иммунизации ротавирусом связывают со способностью его проникать в ткань пейеровых бляшек. Полагают, что реовирусы преодолевают кишечный эпителий благодаря М-клеткам, играющим ведущую роль в доставке чужеродных антигенов и, в том числе, вирусов во внутреннюю среду организма и к его иммунной системе. Эпителиальные клетки, подобные М-клеткам кишечника, обнаружены и среди клеток BALT, их рассматривают как респираторные эквиваленты клеток GALT.
Первичное воздействие антигена вызывает пролиферацию В-клеток, часть которых превращается в иммунобласты и покидает бляшки. Большая часть клеток остается в бляшках в виде чувствительных к данному антигену В-клеток. При повторном контакте с тем же антигеном эти клетки превращаются в IgA-иммунобласты, которые пролифелируют и мигрируют сначала в брыжеечные лимфатические узлы, а затем через грудной лимфатический проток в кровеносное русло. Часть таких клеток может оседать в отдаленных IgA-секретирующих участках тела. Однако большинство клеток уже в качестве зрелых плазмоцитов осуществляет специфический homing в lamina propria, что обусловлено присутствием антигена и свидетельствует о его определяющей роли в данном процессе.
Вторичный иммунный ответ — сильный и быстрый. Он развивается в течение 48—60 ч, достигает максимума на 4—5-й день, а затем быстро снижается.
Мигрирующие Т-клетки также осуществляют homing в эпителиальном слое слизистой оболочки кишечника. Большинство из этих лимфоцитов обладают Т-хелперным фенотипом. Эти клетки, вероятно, могут вовлекаться в реакции клеточного иммунитета, иммунотолерантности, а также в регуляцию гуморального иммунитета.
Стимулированные местно или осевшие из кровяного русла lgA-продуцирующие клетки в собственной пластинке секретируют IgA в виде димера 9S, проникающего в эпителиальные М-клетки, соединяются с образующимся в них секреторным компонентом и выделяются на поверхность слизистой оболочки в виде иммуноглобулина. Одновременно на поверхность эпителиальных мембран выделяется секреторный компонент в виде свободных молекул. Слизь, обогащенная нековалентно связанными секреторными иммуноглобулинами, выстилает поверхность эпителиальных клеток наподобие ковра. Тем самым обеспечивается протективный эффект, предотвращающий адгезию и инвазию инфекционных агентов.
IgM также продуцируются местно и проявляют свойства, сходные со свойствами секреторного IgA. Показано, что пентамерные 19S молекулы IgM содержат секреторный компонент, хотя эта связь менее прочная.
Продолжительная защита слизистых оболочек местными антителами может быть обусловлена длительной, хотя и умеренной выработкой антител после окончания специфического антигенного воздействия или быстроактивизируемой иммунологической памятью. Обнаружение в системе слизистых оболочек первичного и вторичного иммунного ответа свидетельствует о наличии в ней местной иммунологической памяти, однако ее длительность и уровень вторичного ответа могут зависеть от многих факторов. Например, мыши, иммунизированные интраназально коронавирусом гепатита, имели более продолжительный иммунитет, чем привитые орально. На примере ротавирусной инфекции цыплят доказано, что IgA кишечника являются важным, но не единственным фактором защиты. IgA молозива не адсорбируются в кишечнике новорожденных и остаются там, проявляя местный защитный эффект, нейтрализуя вирус.
Микробиота кишечника: Почему мы с бактериями — единое целое
Ещё в начале XX века нобелевский лауреат Илья Мечников предположил, что микрофлора кишечника может определять физическое и даже психическое здоровье человека. Технологии того времени не позволяли подтвердить или опровергнуть эту теорию, но сегодня с уверенностью можно сказать: российский биолог был прав в своих догадках. За последние несколько лет скопился огромный массив данных о населяющих нас микроорганизмах. Оказалось, что их намного больше, чем предполагалось, они отвечают за множество важных процессов и, по сути, живут в абсолютном симбиозе с человеком: мы никак не можем без них, а они — без нас.
Текст: Василиса Кирилочкина

Из чего состоит микробиом
Несколько лет назад на фоне всплеска интереса к теме вместо привычного понятия микрофлоры стали всё чаще звучать более современные термины: микробиом и микробиота. «Микробиом — это экосистема, в которой живут микроорганизмы и ресурсами которой они пользуются. Есть микробиом почвы, океана и других природных ниш. У человека тоже есть разные микробиомы — кожи, кишечника, дыхательных путей и мочеполового тракта. А микробиотой, или микрофлорой, называют сами организмы (бактерии, грибы, вирусы, археи и другие простейшие), которые можно выделить из этой экосистемы и изучить», — объясняет Елена Ильина, доктор биологических наук, руководитель отдела молекулярной биологии и генетики Федерального научно-клинического центра физико-химической медицины ФМБА России. Тем не менее часто термины «микробиом» и «микробиота» используют как синонимы.
Главным стимулом к новым исследованиям микробиоты в начале XXI века стало развитие геномного секвенирования — метода, позволяющего прочитать геном того или иного организма. Чем доступнее и точнее становилась это технология, тем больше микробиологов использовали её в своих исследованиях. Постепенно представление о составе микрофлоры человека изменилось — оказалось, она намного разнообразнее и таинственнее, чем думали раньше. Например, генов бактерий в нашем организме нашлось в 150 раз больше, чем наших собственных. В этом смысле человека можно считать суперорганизмом — не одним, а целой группой синергически взаимодействующих живых существ. Этот термин упоминается в книге американского биолога Родни Дитерта, сформулировавшего идею, что мы не только люди, но и микробы.
При этом состав микробиоты разных людей сильно различается — он зависит от образа жизни, факторов окружающей среды, питания и множества других аспектов, начиная с момента рождения человека. Этому феномену было посвящено большое европейское исследование, результаты которого опубликовали в журнале Nature в 2011 году — тогда учёные впервые выделили так называемые энтеротипы городских жителей со всей планеты. Оказалось, что у разных людей, независимо от континента и страны проживания, в кишечнике превалируют разные группы бактерий — например, бактероиды, руминококки и другие — и всё это разнообразие можно считать вариантами нормы. Но сегодня, спустя всего восемь лет после открытия, к энтеротипам обращаются всё реже — потому что накопился новый огромный массив данных, говорящий о ещё большем разнообразии микробиомов и их эффектов.
Главной и постоянно обновляемой базой данных о биологическом разнообразии организмов, живущих внутри нас, сегодня можно считать проект «Микробиом человека», который стартовал в недрах Национального института здоровья США ещё в 2007 году. Во время первой фазы проекта, которая продлилась до 2014 года, учёные изучали и описывали состав микробиоты кишечника, кожи, гениталий и других экологических ниш тела человека. Вторая фаза, которая продолжается до сих пор, посвящена исследованию влияния этой микрофлоры на наше здоровье. Если суммировать данные, полученные в ходе этого проекта и других исследований по всему миру, получится, что микробиом влияет примерно на всё. А особенно сильно мы зависим от состояния микрофлоры кишечника. В частности, она связана с аутоиммунными воспалительными заболеваниями: болезнью Крона и язвенным колитом, — но это только вершина айсберга. Микробиом кишечника может влиять на работу сердечно-сосудистой системы, повышать риск развития сахарного диабета, оказывать влияние на работу мозга и иммунной системы — например, эффективность терапии при некоторых онкологических заболеваниях сильно зависит от того, как на неё реагирует микрофлора кишечника.
Существует ли дисбактериоз
Мы знаем о микробиоме много, но пока не разобрались с главным — его реальным составом. Мы до сих пор не всегда понимаем, что видят супермощные машины для расшифровки генома. «Иногда, углубляясь всё дальше, мы находим тёмную материю — фрагменты ДНК, которые не можем приписать ни к чему живому, известному нам. Мы никогда не видели их раньше и не понимаем их природу. Таких участков — процентов 20-30 от всего метагенома организмов, живущих в нас», — говорит Ильина.
Логично, что если мы не понимаем состав нормальной микрофлоры, которая к тому же разная у всех людей, то никакого диагноза «дисбактериоз» существовать не может. В доказательной медицине его и нет. Хотя на постсоветском пространстве нежелательные эффекты антибиотиков любят объяснять дисбактериозом, пытаясь лечить последний, авторитетные медицинские организации называют их просто «ассоциированной с антибиотиками диареей»; в некоторых случаях речь идёт об острой инфекции бактериями Clostridium difficile, но опять же не о дисбиозе или нарушении баланса микрофлоры.
К сожалению, в постсоветских странах и диагноз «дисбактериоз», и рекомендации обследования на него можно встретить часто. Такую практику критикуют и учёные, и врачи. Гастроэнтеролог Алексей Головенко в своём телеграм-канале прямо пишет, что сегодня рекомендация «сделать посев кала на дисбактериоз» — индикатор бездоказательного подхода к диагностике и лечению: «Норму для количества разных бактерий в кале определили неизвестно как. Да и само понятие „нормального“ состава кишечной микрофлоры — чепуха. Микрофлора — штука поиндивидуальнее отпечатка пальцев». С ним согласна Ильина: «Думаю, в научной терминологии дисбактериоз приобретёт звучание, только когда мы перейдём на персонализированную медицину — будем с самого рождения и на протяжении всей жизни мониторировать человека и понимать, какая флора является для него нормальной, а когда возникает дисбаланс».
Ещё один сомнительный, но популярный исключительно в России тест на состав микрофлоры — ХМС-анализ крови, также известный как тест на микробиоту по Осипову. У каждого вида бактерий свой набор жирных кислот, и их можно идентифицировать с помощью хроматографии с масс-спектрометрией — именно на этой технологии основан метод учёного Георгия Осипова. Из крови выделяют жирные кислоты, идентифицируют и на основе полученных данных определяют состав микробиоты. Вопросы вызывает точность такого теста. «Какие-то жирные кислоты из микрофлоры кишечника действительно могут всасываться в кровь, но далеко не все, поэтому выборка получается нерепрезентативной», — объясняет Ильина.

Нужно ли искать свою норму
Во взрослой жизни (примерно с 18 до 65 лет) наш микробиом невероятно устойчив — к совершеннолетию он достигает равновесия и сохраняет его, несмотря на внешние воздействия — иначе мы бы просто не выжили. Это состояние микрофлоры кишечника считается доминантным (его ещё называют конституционным); состав микробиома при временных изменениях называют транзиторным, или преходящим. «Известно, что бактерии из пробиотических препаратов не приживаются, а проходят как транзиторная флора. Они могут дать кратковременный эффект, но не займут никаких экологических ниш», — говорит Ильина. После курса антибиотиков пробиотики иногда могут помочь чуть быстрее восстановиться, правда, не всем — исследования показывают, что люди по-разному реагируют на такое вмешательство в микробиом кишечника. Как бы то ни было, не стоит рассчитывать, что ежедневная порция живого йогурта изменит микрофлору в долгосрочной перспективе.
Чтобы понять хотя бы приблизительный состав своей доминантной микрофлоры, можно сделать генетический тест микробиоты. Загвоздка в том, что он показывает только текущий состав населения кишечника. Чтобы сравнить его в разных периодах и выделить «костяк», придётся сдавать такой тест несколько раз за год (а стоит он больше десяти тысяч). При этом пока непонятно практическое применение полученных знаний: диагностировать клинические заболевания можно другими, более доступными способами. Как отмечает Алексей Головенко в своём блоге, «Цель любого анализа — изменить схему лечения. Пока мы не можем „подсадить“ в кишечник конкретную недостающую бактерию. Никак. А значит, даже полноценный генетический тест микрофлоры нам пока не нужен».
Как заботиться о микробиоме
На сегодняшний день самый простой и доступный способ заботиться о микрофлоре кишечника — придерживаться здорового образа жизни и, как бы банально это ни звучало, прислушиваться к организму. Например, известно, что повышенное потребление сахара действительно может негативно влиять на микрофлору и способствовать активному размножению грибков Candida в организме. Но одним для этого достаточно кусочка торта, а другие не испытают проблем и от коробки пирожных, запитых фантой. Здоровый человек может отслеживать своё состояние после приёмов пищи, отмечая, на какие продукты организм реагирует особенно чувствительно. Но, конечно, при появлении проблем не стоит заниматься самолечением — нужно обратиться к терапевту или гастроэнтерологу.
В целом рекомендации по «уходу за микробиомом» для всех общие и на удивление совпадают с рекомендациями для поддержания здоровья в целом: есть побольше богатых клетчаткой овощей и злаков, не злоупотреблять сахаром, пить достаточно воды, хорошо спать и регулярно двигаться. А ещё с помощью еды можно улучшить себе настроение и бороться со стрессом — и речь здесь не о еде вроде мороженого, а о продуктах, которые помогают бактериям вырабатывать нейроактивные вещества и положительно влиять на работу нервной системы. В полезном списке всё те же богатые антиоксидантами ягоды и фрукты, насыщенный триптофаном сыр и бананы, орехи и рыба с высоким содержанием жирных кислот омега-3.
Микробиом: мир внутри нас

Десятки триллионов микробов проживают в нашей пищеварительной системе. Большинство из них живут в толстой кишке, и только около 10000 в тонком кишечнике, еще от 100 до 200 различных видов обитают в нашей ротовой полости. Приблизительно одна треть кишечного микробиома одинакова у всех людей, а оставшаяся часть уникальна для каждого человека.
Вес всех микроорганизмов, которые живут в нашем теле, зависит от его массы и составляет от 1,2 до 3,5 кг, а их общий геном в 300 раз превышает человеческий. И данное сравнение здесь не для красного словца. Многие гены бактерий функционально дополняют ядерный геном человека, а также имеют настолько тесное межвидовое взаимодействие с другими микроорганизмами, что не могут существовать друг без друга.
Однако стоит учесть, что не все эти микроорганизмы несут пользу, некоторые из них вредят нам. Например, довольно известная бактерия Helicobacter pylori (H. pylori), способна достаточно долго выживать в кислой среде желудка и колонизировать его слизистую, тем самым нарушая ее защитные свойства, что часто приводит к язвам и гастриту.
Влияние микробиома кишечника на нашу жизнь
Это общеизвестный факт, что кишечные бактерии критически важны для пищеварительной системы, а также снабжают нас полезными веществами, однако не все знают об их прямом влиянии на наше поведение и настроение. Более того, есть смелые теории, что они также способны влиять на наши вкусовые предпочтения. Имея симбиотическую связь с нами, они выделяют множество химических соединений, которые способны проникать в мозг, а также взаимодействовать с иммунной и гормональными системами.
Микробиом оказывает огромное влияние на наше здоровье. Например, присутствии некоторых патогенных видов или отсутствие полезных микроорганизмов могут приводить к различным неблагоприятным состояниям и болезням. Кроме конкретных заболеваний вызванных тем или иным возбудителем, плохая кишечная микрофлора может способствовать депрессии, аутизму, рассеянному склерозу, сахарному диабету и ожирению.
Но пробежимся по полезным эффектам, которые мы получаем от такого «сожительства».
Пищеварение
Пищеварение — это сложный процесс превращения пищи в питательные вещества, которые наш организм может использовать как материал для строительства новых тканей, поддержания жизнедеятельности старых, а также для производства регулирующих химических соединений, энергии и много другого. Удивительно, но не смотря на миллионы лет нашей эволюции, без микробов, мы не способны полноценно переваривать и усваивать пищу.
Иммунитет
Наука считает, что около 70% нашей иммунной системы происходит из кишечника. Микробы связываются с иммунными клетками и контролируют реакцию организма на инфекции. Они также выделяют вещества, которые делают кишечную и слизистую среды неблагоприятными для патогенных микроорганизмов и грибков.
Здоровье мозга
Новые исследования показывают, что центральная нервная система и кишечный микробиом тесно связаны. Передача сигналов в мозге происходит посредством выделения из синапсов специальных молекул — нейромедиаторов. Наверняка вы слышали о таких нейромедиаторах как серотонин, дофамин, ГАМК, гистамин и норадреналин, которые активируют или тормозят нейроны в мозге и регулируют ваше поведение и настроение.
Так вот, некоторые микробы способны вырабатывать эти нейромедиаторы, но также множество других химических соединений, которые используются организмом для их синтеза.
Контроль уровня сахара в крови
Исследование показало, что менее разнообразные микробиоты кишечника связаны с диабетом первого типа у детей. Было также обнаружено, что некоторые грамотрицательные бактерии были более распространенными непосредственно перед постановкой этого диагноза. Кроме того, постпрандиальный уровень сахара в крови широко варьируется среди населения, даже когда мы потребляем одну и ту же пищу. И это может быть отчасти связано с различиями в кишечных бактериях.
Большинство нейромедиаторов, таких как серотонин и дофамин, находятся в пищеварительном тракте, а не в мозге. Эти два органа общаются друг с другом по оси кишечник-мозг, что очень тесно связывает наше психическое и желудочно-кишечное благополучие. Не только пища, которую мы едим, оказывает глубокое влияние на наше психическое состояние, но и психологический стресс также отрицательно влияет на пищеварение.
Сердечно сосудистая система
Микробиом кишечника играет важную роль в обеспечении оптимального уровня холестерина ЛПВП и триглицеридов. Некоторые штаммы бактерий преобразуют питательные вещества, содержащиеся в красном мясе, в ТМАО (триметиламиноксид), химическое вещество, которое способствует закупорке артерий, что может привести к инфаркту миокарда или инсульту. И наоборот, другие виды, такие как лактобациллы, могут снижать уровень холестерина ЛПНП при приеме в пробиотической форме.
Масса тела
Многие исследования показали связь между дисбактериозом кишечника или неблагоприятным балансом хороших и плохих микробов и ожирением. В экспериментах на грызунах, им имплантировали микробиом от людей с ожирением, и они набирали больше веса, чем те, которые получили бактерии от худощавых людей. Эта закономерность соблюдалась, даже когда у них была одинаковая диета.
Это далеко не исчерпывающий список, но надеюсь, вы получили представление насколько важен кишечный микробиом для всех аспектов нашего здоровья.
Микробиом постоянно меняется
Утроба матери является стерильной средой, но во время рождения, по мере преодоления родовых путей мы получаем первую микробиоту. Далее мы пополняем свое разнообразие бактерий из грудного молока. В основном это лактобациллы и бифидобактерии, которые подавляют условно-патогенных клостридий и бактериоидов. Обычно это и формирует основной костяк наших микробов, дальнейшее обогащение микробиома зависит от образа жизни человека.
Чем старше мы становимся, тем больше различных видов бактерий в нас проживает, однако использование антибиотиков и некоторых средств гигиены негативно влияют на их разнообразие.
Если вы заботитесь о своем здоровье, то вам может быть интересно знать, что есть еда, которую бактерии особенно любят, ее общее название — пребиотики.
Пребиотики
Пребиотик — это тип клетчатки, которая проходит через кишечник непереваренной. Хоть он и не дает никакой питательной пользы человеку, наши кишечные микроорганизмы любят это! Микробы питаются этим веществом, и его регулярное потребление способствует их росту и разнообразию. Пребиотики встречаются в природе во многих продуктах, включая бобовые, овес, бананы, топинамбур, спаржу, чеснок, лук и орехи. Но помимо пребиотиков есть еще и пробиотики.
Пробиотики
Пробиотики — это «хорошие» бактерии или другие живые организмы, такие как дрожжи, которые содержатся в продуктах питания или пищевых добавках. Из продуктов питания они могут содержаться в некоторые соках и соевых напитках, йогуртах и кефире, неферментированном молоке, кимчи и кислой капусте.
Наиболее распространенные пробиотические бактерии происходят из двух групп: Lactobacillus и Bifidobacterium. Например, в йогуртах часто содержится Lactobacillus acidophilus, однако некоторые производители могут добавлять другие штаммы полезных бактерий.
В свою очередь, специальные пробиотические добавки, которые доступны в капсулах, таблетках, порошках и жидких экстрактах, содержат определенные штаммы бактерий. Эффектам пробиотиков можно посвятить отдельную большую статью, поэтому мы коротко рассмотрим лишь несколько исследований, которые проводились с бактериями Lactobacillus rhamnosus и Lactobacillus reuteri.
Например, обзор 12 исследований с участием 1499 человек показал, что добавление специфического штамма L. rhamnosus GG снижает риск диареи, связанной с антибиотиками, с 22,4% до 12,3%. Этот вид бактерий также может облегчить симптомы синдрома раздраженного кишечника (СРК), который поражает 9–23% взрослых во всем мире.
Кроме того, L. rhamnosus может препятствовать заселению Candida albicans (один из вредных видов бактерий) и способствовать росту благоприятной микрофлоры. Другое исследование описывает способность этой бактерии увеличивать выработку короткоцепочечных жирных кислот (SCFA), таких как ацетат, пропионат и бутират. SCFA связывают с различными преимуществами, включая защиту от рака толстой кишки, потерю веса и снижение уровня сахара в крови.
Другие исследования на животных показывают, что некоторые штаммы L. rhamnosus могут улучшить чувствительность к инсулину и контролировать уровень сахара в крови.
Бактерии вида L. reuteri могут продуцировать антимикробные молекулы, такие как органические кислоты, этанол и реутерин. Благодаря своей антимикробной активности L. reuteri способны ингибировать колонизацию патогенных микробов и реконструировать композицию комменсальной микробиоты.
Эта бактерия также приносит пользу иммунной системе. Например, некоторые штаммы L. reuteri могут снижать выработку провоспалительных цитокинов, одновременно стимулируя развитие и функцию регуляторных Т-клеток.
Очень интересное исследование было проведено на стареющих крысах, которое показало, что штамм Lactobacillus reuteri (ATCC 6475) является очень полезным для гормональной системы мужчин. Вот такие эффекты были получены:
- увеличение выработки тестостерона
- более высокий уровень лютеинизирующего гормона
- более высокий уровень фолликулостимулирующего гормона
- увеличенное количество сперматозоидов с лучшей подвижностью
- увеличение размера яичек
Lactobacillus reuteri подавлял связанное с возрастом сокращение яичек у крыс (это происходит и у людей), и фактически увеличивал их размеры.
Доминирующее поведение крыс, получавших пробиотики, и значительно более высокий уровень тестостерона преобладали даже тогда, когда исследователи использовали несколько различных диет.

Ученые заявили, что диетическая L. reuteri может обеспечить естественный подход к профилактике возрастного снижения уровней тестостерона у мужчин.
Как видите, мир бактерий удивителен, и пусть мы этого не видим, но он оказывает огромное влияние на нашу жизнь.
Надеемся вам понравилась статья, всего доброго и хорошего вам здоровья.

Пресноводная мегафауна сократилась на 88% с 1970 года

Новые препараты против вируса Эбола оказались успешными



