Показания. Экстрамукозная кардиопластика по Геллеру и её модификации Операция геллера с какого года проводится
Показания. Экстрамукозная кардиопластика по Геллеру и её модификации Операция геллера с какого года проводится
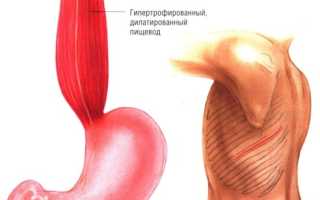
а) Показания к операции Геллера при ахалазии пищевода. Ахалазия — заболевание пищевода, проявляющееся дисфагией вследствие неспособности к расслаблению нижнего сфинктера пищевода и отсутствия прогрессивной перистальтики пищевода. Неспособность сфинктера к расслаблению при глотании, а также высокое давление покоя в пищеводе — характерные черты этой болезни. В течение долгого периода она бессимптомна.
Поскольку признаки дисфагии нарастают постепенно и во многих случаях не принимаются всерьёз больным, к моменту установления диагноза расширение пищевода может быть очень большим. Во многих клиниках ахалазию сначала лечат либо методом расширения баллоном, либо местными инъекциями ботулинического токсина. Каждую процедуру приходится повторять дважды или более.
Как минимум, у половины больных такое лечение оказывается безрезультатным. Для тех больных, которые не ответили на консервативную терапию (или тех, у которых после неё развились рецидивы), операцией выбора становится разрушение нижнего сфинктера пищевода — эзофагомиотомия по Геллеру — и создание нового сфинктера при пластике пищевода по методике Belsey Mark IV.
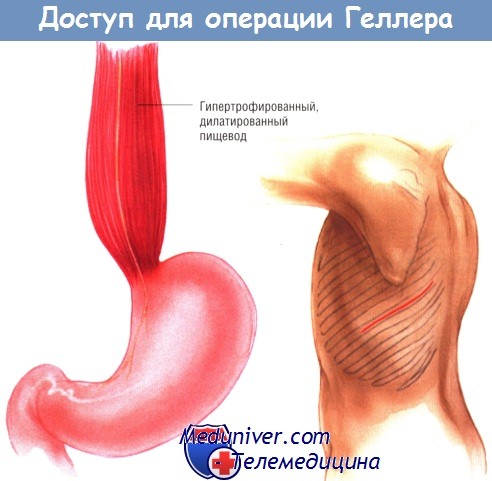
б) Техника операции Геллера при ахалазии пищевода. Больного помещают в положение для боковой торакотомии с приподнятой правой стороной груди. В левую плевральную полость входят в шестом или седьмом межреберье. Рассекают плевру средостения, после чего без особых трудностей находят значительно расширенный и гипертрофированный пищевод.
Тупым и острым путём его мобилизуют из средостения. Пищевод обводят дренажем Пенроуза. Расширяют пищеводное отверстие диафрагмы до такого размера, чтобы дно желудка можно было поднять в грудную полость. Для этого необходимо пересечь ветви левых желудочных сосудов вдоль малой кривизны желудка и короткие сосуды по большой кривизне. Дистальную часть пищевода, кардиальный отдел и дно желудка выделяют из забрюшинного пространства.
P.S. Операция может быть выполнена из трансабдоминального доступа с использованием мобилизации левой доли печени и сагиттальной диафрагмотомии. Операция завершается антирефлюксной фундоплекацией по Toupet.
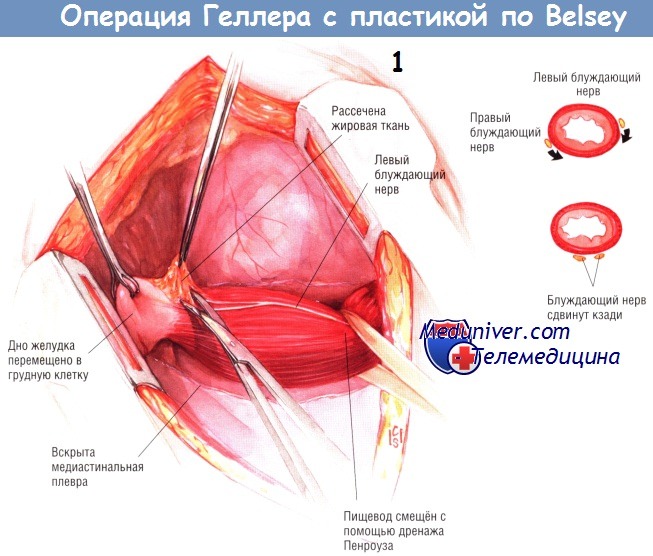
Когда пищевод и желудок будут достаточно мобилизованы, отделяют жировую прослойку от пищеводножелудочного перехода. Находят блуждающие нервы и тщательно оберегают их, отводя кзади (вставка). Выполняют эзофаготомию, поднимаясь вверх по пищеводу приблизительно на 10 см и опускаясь на желудок приблизительно на 1 см.
Лучше всего делать это, поднимая мышечный слой пищевода от слизистой оболочки прямоугольным зажимом, а затем разделяя мышечные волокна диатермокоагулятором при малом напряжении тока. Мышечный слой пищевода легко отделяется от трубки слизистой оболочки. Его необходимо освободить, как минимум, на 50% окружности пищевода.
Однако у небольшой доли больных, перенёсших до операции многократные дилатации пищевода или инъекции токсина, могут быть рубцы между мышечным слоем и слизистой оболочкой. Целостность слизистой оболочки можно проверить, введя в пищевод гибкий эзофагоскоп, а затем залив раствор натрия хлорида в операционную рану. Раздувание пищевода при одновременном сдавлении его дистального отдела вызовет появление газовых пузырьков в местах перфорации слизистой оболочки. Последние следует зашить рассасывающейся нитью № 4/0 до проведения фундопликации.
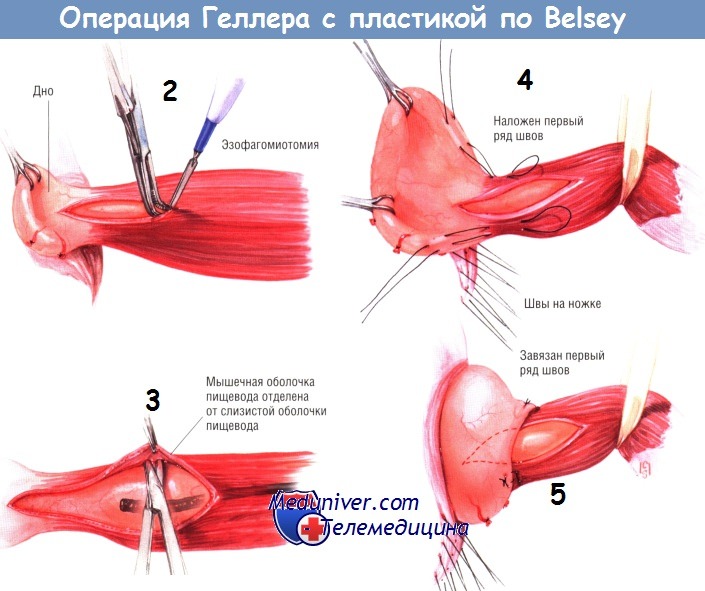
Когда эзофагомиотомия будет сделана и дистальный сфинктер пищевода разрушен, создают новый сфинктер по модифицированной методике Belsey Mark IV. Через ножки пищеводного отверстия диафрагмы проводят шёлковую нить № 2/0, но не завязывают её. После эзофагомиотомии можно наложить лишь два шва в каждом ряду, используемом при пластике по Belsey. Сначала накладывают швы первого ряда.
Они проходят от дна желудка, на расстоянии 2 см от пищеводно-желудочного перехода и поднимаются вверх по пищеводу на 2 см от пищеводно-желудочного перехода. Матрацный шов завершают проводя стежок вниз, через пищевод и дно желудка. По каждой стороне от эзофагомиотомии на кладывают по шву и затем завязывают их.
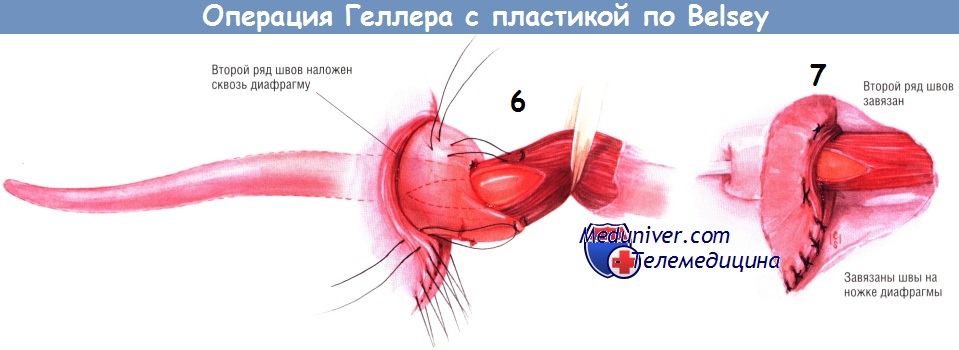
После этого размещают швы второго ряда. Стежки проходят от дна желудка, через пищевод и затем вниз по пищеводу и дну желудка на расстоянии 2 см от первого ряда швов. Их завязывают, а потом концы их нитей продевают в большие иглы Фергюсона, которыми проводят нити через диафрагму с её абдоминальной стороны на торакальную. Затем дно желудка вправляют в брюшную полость и завязывают нити.
Нити, ранее наложенные на ножки диафрагмы, завязывают. При этом дилататор Maloney 46 Fr должен находиться в пищеводе. Поскольку пищевод не перистальтирует, не нужно применять фундопликацию по Ниссену для создания нижнего сфинктера пищевода, так как эта процедура может привести к его частичной обструкции.
Оборачивая пищевод лишь на две трети окружности при помощи операции Belsey Mark IV, хирург создаёт сопротивление на уровне нижнего сфинктера, не вызывая функциональной обструкции. После введения дренажной трубки в плевральную полость рану грудной стенки зашивают.
Показания. Экстрамукозная кардиопластика по Геллеру и её модификации Операция геллера с какого года проводится
Проведен анализ результатов эндохирургического лечения 141 пациента ахалазией кардии. Всем больным была выполнена лапароскопическая эзофагокардиомиотомия по Геллеру – Дору. Для интраоперационного контроля целостности слизистой оболочки пищевода использовался трансиллюминационный зонд. Положительные результаты малоинвазивного лечения достигнуты у 82,3% больных. Среди осложнений превалировала интраоперационная перфорация слизистой оболочки пищевода. Послеоперационный рецидив дисфагии диагностирован у 12% больных. Лечение данной категории пациентов потребовало строго индивидуализированной тактики.
Results of endosurgical treatment at achalasia cardia
The analysis of results of endosurgical treatment of 141 patients with achalasia cardia is carried out. All patients executed a laparoscopic esophagocardiomiotomy according by Geller – Dor. For intraoperative control of integrity of a mucous membrane of esophagus the transillumination probe was used. Positive results of low-invasive treatment are reached at 82,3% of patients. Among complications intraoperative perforation of mucous membrane of esophagus prevailed. Postoperative recurrence of a dysphagy is diagnosed for 12% of patients. Treatment of this category of patients demanded strictly individualized tactics.
Среди заболеваний различных органов и систем одно из первых мест принадлежит патологии желудочно-кишечного тракта. Немалая часть из них приходится на долю доброкачественной патологии пищевода. Это относится к таким заболеваниям, как ахалазия кардии (АК), грыжи пищеводного отверстия диафрагмы, подслизистые доброкачественные опухоли и дивертикулы пищевода. Нередки случаи, когда доброкачественная патология пищевода вовремя не диагностируется. Данное обстоятельство объясняется недостаточным знакомством большинства врачей разных специальностей с вопросами диагностики и лечения доброкачественной патологии пищевода [1].
Несмотря на доброкачественный характер вышеперечисленных заболеваний пищевода, при их несвоевременном лечении развиваются тяжелые осложнения, которые могут привести к гибели больного. Так, N. Barrett (1964) на основании своих наблюдений считал АК «фатальной болезнью», поскольку она явилась причиной преждевременной смерти многих его пациентов от перфорации пищевода, медиастинита, рака пищевода и кахексии [2].
Наиболее раннее упоминание об АК в литературе относилось к 1672 году и принадлежало английскому врачу T.Willis, который описал больного, страдавшего дисфагией и регургитацией. В 1679 году в Лондоне вышла его книга «Pharmaceutice rationales sive diatribe de medicamentorum operationibus in humono corpora», в которой было описано заболевание пищевода, возникшее без видимых причин, сопровождающееся задержкой пищи, срыгиванием и расширением органа.
Первое в истории анатомическое описание заболевания с расширенным пищеводом, но без опухоли или ожога, принадлежало P. Purton в 1821 году, который изучил трупы трех больных, умерших от истощения вследствие дисфагии. Впоследствии J. Mikulicz в 1882 году назвал данную патологию кардиоспазмом. Сам термин «ахалазия» предложил С. Perry, а ввел в практику A. Hurst в 1914 году. Данный термин наиболее точно отражает клиническую сущность заболевания: по-гречески «а» — отрицание, «халазис» — расслабление.
АК — заболевание, характеризующееся нарушением рефлекторного раскрытия кардии при глотании, нарушением перистальтики и прогрессирующим снижением тонуса тубулярного отдела пищевода [3]. АК наиболее часто встречается в трудоспособном возрасте — 20-50 лет [4, 5], нередко приводит к тяжелой алиментарной дистрофии, иногда к инвалидности пациента. АК является предраковым заболеванием: риск возникновения рака пищевода на ее фоне увеличивается в 14,5-33 раза [6-8], частота злокачественной трансформации заболевания составляет 88 человек на 100 000 пациентов с АК, что указывает на необходимость более раннего выявления и лечения этой группы больных [9].
В настоящее время в лечении АК широко применяются различные малоинвазивные методы: лапароскопическая кардиомиотомия по Геллеру – Дору, различные варианты кардиодилатации, эндоскопическое интрасфинктерное введение ботулинического токсина А [3-5].
На сегодняшний день наиболее оптимальным способом лечения АК, признанным во всем мире, следует считать, разработанную E. Heller в 1913 году переднюю вертикальную внеслизистую эзофагокардиомиотомию, так как данная операция обеспечивает адекватный пассаж пищи в желудок из пищевода [10, 11]. Но небольшому по объему и простому в техническом отношении внутриполостному этапу операции предшествовало травматичное чревосечение (лапаротомия или торакотомия). Исходя из данного обстоятельства, показания к операции Геллера были минимизированы.
И все же следует признать, что наиболее эффективным методом лечения АК оставалось оперативное пособие, при котором хорошие и отличные результаты достигали 95% в ближайшем послеоперационном периоде, а также на сроках более 5 лет [12]. Внедрение эндохирургических технологий оказало, несомненно, революционное влияние на хирургическое лечение АК. Многочисленные исследования продемонстрировали высокую эффективность лапароскопической операции Геллера – Дора, результативность которой была сопоставимой с эзофагокардиомиотомией, выполняемой из лапаротомного доступа [13, 14]. При этом пациенты уже на 2–3-и сутки могли быть выписаны из стационара. Эффективность лапароскопической эзофагокардиомиотомии по Геллеру – Дору несомненна: отличные результаты были достигнуты у 80-95% больных [11, 15].
Однако, несмотря на малую травматичность доступа, хороший косметический эффект, раннюю реабилитацию больного, имеются специфические осложнения в ходе лапароскопической эзофагокардиомиотомии в виде интраоперационной перфорации слизистой пищевода, которая встречается по данным литературы, в 8-25% случаев [16, 17]. Как в раннем послеоперационном периоде, так и на отдаленных сроках после эндохирургического вмешательства рецидивы дисфагии развиваются у 5-14% больных [18, 19].
Материалы и методы
В период с 1998 по 2011 год на базе отделения хирургии пищевода (онкологическое отделение № 2) Республиканского клинического онкологического диспансера Министерства здравоохранения Республики Татарстан 141 больному АК выполнили лапароскопическую операцию Геллера – Дора. Мужчин было — 66 , женщин — 75. Возраст больных составил от 18 до 78 лет (в среднем 48 лет). Распределение больных, в зависимости от показаний к выполнению лапароскопической операции Геллера – Дора представлены в таблице 1.
Показания к лапароскопической операции Геллера – Дора
Экстрамукозная кардиопластика по Геллеру и её модификации
Ещё в 1901 году Готтштейн (G. Gottstein) внёс предложение рассекать в продольном направлении только мышечную оболочку эзофагокардиального отдела пищевода. Немного позже (в 1913 году) его идеей воспользовался Геллер (Е. Heller).
Вариант экстрамукозной кардиопластики, выполняемой по Геллеру, предполагает осуществление манипуляций из брюшностеночного доступа и заключается в продольном разрезе мышечной оболочки дистального отдела пищевода по его передней и задней стенкам на протяжении восьми-десяти сантиметров. При этом миотомия должна захватывать не только область сужения и кардиальный отдел желудка, но и частично эктазированный (расширенный) участок пищеводной трубки. Края рассечённой мышечной оболочки аккуратно разводят в противоположные стороны, и в результате в образовавшийся дефект начинает выбухать подлежащая неповреждённая слизистая оболочка.
Согласно сводным статистическим данным, хорошие результаты после хирургического вмешательства, произведенного по данной методике, наблюдаются где-то в 70-95% случаев. У некоторых пациентов имеют место неудовлетворительные результаты, связанные с рецидивом заболевания, недостаточностью кардиального жома, развитием пептического рефлюкс-эзофагита и т.д. Кроме того, в местах рассечения мышечной оболочки пищевода после хирургического вмешательства по Геллеру не исключается образование дивертикулов и деформирующих кардию рубцов.
Летальность после операции по Геллеру в среднем составляет 1,5% (ряд авторов приводит цифру 4%). В роли её основной причины обычно выступают упущенные из виду повреждения слизистой пищевода, которые приводят к медиастиниту (воспалению клетчатки средостения), плевриту (воспалению плевры) и перитониту (воспалению брюшины).
Подобного рода травматизация наблюдается в 6-13% всех операций, поэтому для профилактики тяжёлых осложнений крайне важно проводить очень тщательную ревизию, не упуская из внимания мельчайших деталей. Если же обнаруживается повреждение слизистой оболочки пищеварительного канала, оно должно быть обязательно нивелировано.
На сегодняшний день существуют самые разные способы прикрытия слизистой оболочки. Для чего может быть использован сальник, передняя стенка желудка и т.п. При этом необходимо отметить, что варианты закрытия дефекта мышечной оболочки пищевода какими-либо синтетическими материалами настоятельно не рекомендуются.
Очень важно (для профилактики развития недостаточности кардиального жома и рефлюкс-эзофагита) максимально, насколько возможно, сохранить естественные анатомические взаимоотношения пищевода, желудка и диафрагмы.
Для предупреждения рецидивов ахалазии кардии в 1951 году Лорта-Жакоб (J. L. Lortat-Jacob) предложил не разрезать мышечную оболочку органа, а иссекать из неё полоску ткани, а в 1972 году Б. В. Петровский с соавторами начали сочетать классическую операцию по Геллеру с эзофагофундорафией либо фундопликацией по Ниссену (Nissen).
К тому же, для уменьшения травматичности операции на современном этапе стали обращаться к лапароскопическому варианту методики.
(495) 51-722-51 – хирургия грыжи пищевода и ахалазии кардии в Москве и за рубежом
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
Авторская методика профессора Пучкова К.В.
.jpg)
В ходе лапароскопического лечения грыж пищеводного отверстия диафрагмы по авторской методике профессора К.В. Пучкова, пищевод вместе с верхней частью желудка выделяются из окружающих их спаек и низводятся в брюшную полость. Выполняется крурорафия пищеводное отверстие диафрагмы уменьшается и осуществляется фундопликация
Профессор, д.м.н, эндоскопический хирург – Феденко Вадим Викторович

Ахалазия кардии – видео-лекция проф. Феденко В.В. о современном лечение ахалазии кардии.
Непосредственные результаты оперативного лечения ахалазии пищевода
Среди 170 наблюдавшихся нами больных оперативное лечение выполнено у 75 чел. (44,1+3,8%). Преобладали пациенты с III и IV стадией АП (по 32 чел. 42,7+5,7%), со II стадией было 11 больных (14,6+0,2%). Пациентам с I стадией АП оперативное лечение не применялось.
Использованы различные оперативные доступы (Табл. 15). Большинство больных оперировано видеолапароскопически -50 чел (66,7+5,4%). До внедрения в практику нашей клиники видеоэндоскопических технологий операции выполнялись из традиционных доступов – у 4 пациентов (5,3+0,3%) использована торакотомия, у 21 (28,0+5,2%) – лапаротомия. С 1997 г. все больные с АП нами оперированы видеолапароскопически. Независимо от доступа выполнялась эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор для закрытия мышечного дефекта в стенке пищевода и создания антирефлюксного механизма.
Модифицированная нами видеолапароскопическая эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор выполнялась следующим образом. Анестезия – общая, комбинированная, с искусственной вентиляцией легких.
Положение больного на операционном столе при введении в наркоз и установки лапаропортов – горизонтальное, на спине. После визуализации брюшной полости больного переводили в положение с поднятым головным концом операционного стола на 20-25 градусов инаклономнаправыйбок на 25-30 градусов. Это положение позволяет сместить внутренние органы и увеличить объем пространства в области оперативного вмешательства. Операционная бригада состоит из 4 человек. Справа от больного находится оперирующий хирург и операционная сестра, слева -2 ассистента.
Справа и слева от головной части операционного столанаходятся двавидеомонитора – один в поле зрения оперирующего хирурга, другой для ассистентов. (Рис. 8).
Для постановки лапаропортов использовали 5 точек (Рис. 9). Точка 1 непосредственно над пупком по срединной линии, где устанавливался 10 мм порт для эндовидеокамеры. Точка 2- вмезогастрии, по среднеключичной линии справа для 10 мм троакара, через который выполнялись основные манипуляции на кардиальном отделе и дне желудка, абдоминальном отделе пищевода. Расположение данной точки было индивидуальным и зависело от анатомических особенностей – расположение круглой связки печени и левой доли печени.
Точка 3- под мечевидным отростком, где устанавливался 5 мм лапаропорт для ретрактора печени. Точка 4- на 2-3 см ниже левой реберной дуги по среднеключичной линии вводился 5 мм троакар для работы диссектором, аспиратором-ирригатором, иглодержателем, а также для установки контрольного дренажа после операции. Точка 5- влевой боковойобласти живота по передней подмышечной линии для 5 мм лапаропорта через который выполнялась тракция желудка зажимом Бебкокка.
Указанные места введения лапаропортов – по окружности, обеспечивали равноудаленное расположение инструментов по отношению к области оперативного вмешательства и отсутствие механического взаимодействия инструментов в брюшной полости. Оператор использовал в своей работе инструменты установленные в точках 2 и 3, первый ассистент в точках 3 и 4, второй ассистент -1 и 5.
После установки первого лапаропорта создавали пневмокарбоксиперитонеум с поддержанием давления на уровне 12-14 мм рт ст. Операцию начинали с осмотра брюшной полости для исключения сопутствующей патологии брюшной полости, оценки индивидуальных анатомических особенностей и постановки других лапаропортов. Затем выделяли переднюю поверхность абдоминального отдела пищевода и область пищеводно-желудочного перехода. Для этого проводилась послойная пристеночная мобилизация малой кривизны желудка, начиная выше верхних ветвей a. gastric sinistra, идущих перпендикулярно к ней.
Затем рассекалась пищеводно-диафрагмальная связка в области пищеводно-желудочного перехода по направлению к углу Гиса (левому ребру пищевода). Далее пищеводно-диафрагмальная связка по левому ребру пищевода рассекалась до диафрагмы, а затем вдоль диафрагмы до правого ребра пищевода (Рис. 10, 13). Таким образом, выполнялась мобилизация только передней поверхности пищевода и желудочно-пищеводного перехода, без нарушения анатомических соотношений пищевода и желудка в области угла Гиса и связочных структур между дном желудка и селезенкой, удерживающих его в исходном положении, которое в последующем способствует созданию тракции при подшивании рассеченной мышечной оболочки пищевода. Эти манипуляции выполнялись с помощью ультразвукового гармонического скальпеля «Ultrasision» или эндохирургического крючка.
Передняя поверхность пищевода и область пищеводно-желудочного перехода выделялись таким образом, чтобы на их поверхности не было жировой клетчатки (Рис. 12). Протяженность суженого сегмента пищевода определялась визуально. Если престенотическое расширение пищевода располагалось выше уровня диафрагмы, производилось её сагиттальное рассечение, чтобы выделить пищевод не менее чем на 1,5-2 см выше сужения.
На толстом желудочном зонде, эндохирургическим крючком, в режиме резания, по срединной линии передней полуокружности пищевода выполнялась передняя продольная миотомия на протяжении суженого сегмента пищевода.
На 1,5-2 см выше него и дистально до зоны интимного сращения подслизистой и мышечной оболочки кардиального отдела желудка, что соответствует пищеводно-желудочному переходу, мышцы которого составляют единый замыкательный механизм кардии, вместе с мышцами нижней трети пищевода (Рис. 13). При выполнении миотомии важным техническим моментом является полное пересечение всех циркулярных мышечных волокон.
Слизисто-подслизистый слой по левому ребру пищевода отсепаровывался от мышечной оболочки на V окружности пищевода (Рис.14), после чего слизистая оболочка начинала про лавировать между разошедшимися краями мышечного слоя (Рис. 15).
Указанный прием существенно увеличивает диаметр пищевода и предотвращает последующее смыкание рассеченных краев его мышечной оболочки. Этот эффект усиливается за счет оттягивания левого края рассеченной мышечной оболочки пищевода путем подшивания к дну желудка, которое, в некоторой степени, остается фиксированным за счет сохранения анатомических взаимоотношений в области угла Гиса и с селезенкой, которая мало смещена из-за наличия связочного аппарата с окружающими органами.
Далее передняя стенка желудка без натяжения фиксировалась швами к правому краю рассеченной мышечной оболочки. Для этого непрерывным швом снизу вверх дно желудка подшивали к левому краю рассеченной стенки пищевода, а затем сверху вниз по правому краю разреза. Шов накладывается с помощью иглодержателя неабсорбирующимся шовным материалом на атравматичной игле (Рис. 16).
На 2 сутки всем пациентам выполнялось контрольное рентгенологическое исследование для исключения нарушения целостности стенки пищевода, очем судили по отсутствию затеков контрастного вещества за контур пищевода. Подобных осложнений не выявлено ни у одного больного. После этого пациенты начинали питаться с соблюдением строгой диеты – на протяжении 25 суток после операции принимали только жидкую пищу, сисключением острой, холодной, горячей пищи. Начиная с 6 суток, в рацион включали кашицеобразную пищу. Больные выписывались на 7-9 сутки после оперативного лечения.
После видеолапароскопической кардиомиотомии с фундопликацией по Дор интраоперационные осложнения возникли у 4 больных (8,0+0,4%). При выполнении эзофагокардиомиотомии с помощью эндокрючка у них произошла перфорация слизистой оболочки пищевода. Диаметр перфоративного отверстия составил не более 2-3 мм. Осложнение возникало у пациентов с резким истончением стенки пищевода при АП III – IV стадии. Дефект слизистой оболочки зашивали наложением интракорпорального шва абсорбирующимся шовным материалом (Викрил 3-0 на круглой игле). На начальном этапе освоения эндохирургических технологий в 1 наблюдении (2,0+0,2%) потребовалась конверсия доступа (лапаротомия) из-за технических трудностей при наложении интракорпорального шва. При выполнении миотомии из открытых доступов аналогичное осложнение было у 4,0+0,4% больных.
При сопоставлении частоты и характера послеоперационных осложнений (Табл. 16), установлено, что после торакального доступа у всех больных развилась пневмония. Местных осложнений в зоне оперативного вмешательства не отмечено, что объясняется хорошей визуализацией зоны оперативного вмешательства. После операций из лапаротомного доступа осложнения возникали реже, чем после торакального. Однако у одного из больных вследствие перфорации пищевода развилась эмпиема плевры с летальным исходом. После видеолапароскопических и торакальных операций летальных исходов не было. После видеолапароскопической кардиомиотомии осложнений в раннем послеоперационном периоде не было.
У 1 больного после выписки его из стационара на 10 сутки после видеолапароскопической эзофагокардиомиотомии по Геллер с эзофагофундопликацией по Дор наступила перфорация пищевода. Приводим это наблюдение. Больной среднего возраста поступил с жалобами на затруднение прохождения по пищеводу твердой, кашицеобразной и жидкой пищи, боль за грудиной во время еды, периодически возникающее срыгивание пищей. При рентгеноскопии – пищевод содержит слизь в большом количестве, просвет его расширен до 7,0 см. В дистальном отделе пищевод конически сужен до 0,1 см, контуры четкие. Газовый пузырь желудка отсутствует. ЭФГДС – слизистая пищевода бледно-розовая. В просвете мутная жидкость, следы пищи. В дистальном отделе пищевод слегка расширен. Кардия плотно сомкнута, проходима. Поставлен диагноз: Ахалазия пищевода III стадии.
Выполнена видеолапароскопическая эзофагокардиомиотомия по Геллер с эзофагофундопликацией по Дор. Во время операции произошла перфорация слизистой оболочки пищевода, которая была зашита одиночным швом. На 3 сутки после операции пациенту выполнено контрольное рентгенологическое исследование – пищевод расширен до 5 см в диаметре, кардия проходима для густой бариевой взвеси, опорожнение пищевода замедленно. Затеков контраста за контур пищевода нет. На 8 сутки больной выписан в удовлетворительном состоянии. На 10 сутки после употребления грубой, твердой пищи у больного появилась острая боль в верхних отделах живота.
Госпитализирован, при обследовании диагностирована перфорация пищевода. Выполнена лапаротомия, зашивание перфоративного отверстия пищевода, санация и дренирование брюшной полости. Гастростомия. Проводилась комбинированная антибактериальная терапия. Состояние больного стабилизировалось, но в эпигастральной области сформировался трубчатый пищеводный свищ, который самостоятельно закрылся. Через 4 месяца выполнено внебрюшинное закрытие гастростомы. Пациент стал питаться пищей любой консистенции, явлений дисфагии нет.
Время операции из открытого доступа составило 93,9+1,9 минут, при применении видеолапароскопического доступа несколько больше – 108,2+3,5 минут, р
Внимание!
Диагностирует и назначает лечение только врач при очной консультации пациента.
Новости медицины и статьи о лечении рака и профилактике болезней взрослых и детей.
Зарубежные клиники и госпитали – лечение опухолей и реабилитация за границей.
При использовании материалов сайта – активная ссылка обязательна.