Биосинтез соматотропина и других гормонов человека. Получение интерферонов
Гормона роста и интерферона
Современные методы генетической инженерии уже позволили осуществить путём трансформации генов бактерий синтез ценных белков в промышленных количествах. В качестве примера можно указать на производство, с использованием методов генетической инженерии, физиологически активных белков – инсулина, интерферона и гормона роста (соматотропина). Список этих ценных препаратов сейчас расширяется. Синтез физиологически активных белков в микроорганизмах обходится ещё дорого, а промышленная технология ещё до конца не разработана. К тому же способности бактерий к синтезу белковых соединений ограничены. Например, бактерии не способны синтезировать комплексные соединения, в которых молекулы полипептидов связаны с молекулами сахаров.
Биологическая функция многих белков зависит от правильной переработки первичного продукта гена внутри клетки. Такая переработка охватывает, например, протеолитическое расщепление первичных продуктов генов или их гликолизирование. Преимущество сельскохозяйственных животных, по сравнению с бактериями или дрожжами, заключается в способности их клеток правильно перерабатывать желаемый продукт. Известно, что в наивысшую стадию лактации от высокопродуктивной коровы можно ежедневно получать около 1 кг протеина. Имеется возможность промотор коровьего белка казеина соединить со структурной частью желаемого гена ценного белка, например, инсулина или интерферона, а затем инъецировать рекомбинантную ДНК в зиготу или двухклеточный эмбрион. От трансгенных коров можно будет получать в большом количестве ценные белки и это откроет принципиально новое направление в селекции животных.
Инсулин – гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний – сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин – небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочного предшественника – проинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35- звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжёлая форма, для лечения которой больному необходим инсулин (инсулинзависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удаётся справляться с помощью соответствующих диет и режима.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800-1000 г исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг тремя коллективами исследователей в США, Китае и Германии. В 1980 г датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путём замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и длительности действия.
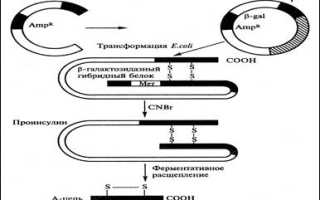
Работы по генно-инженерному получению инсулина начались около 30 лет назад. В 1978 году появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках E. Coli (рис. 8.32):
1.Каждый из полученных синтетических генов подстраивался к 3′-концу гена фермента в-галактозидазы и вводился в векторную плазмиду – pBR322 (1).
2. Клетки E. Coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента в-галактозидазы и А и В пептида инсулина, присоединённого к ней через остаток метионина (2).
3. После обработки химерного белка бромцианом и протеолитического отщепления С-пептида образуется инсулин.
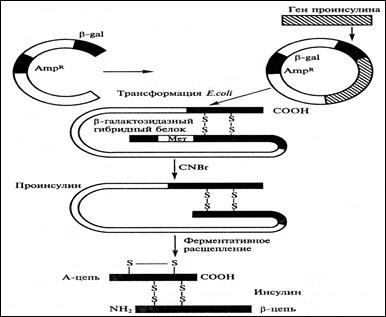
Рис. 8.32. Схема синтеза инсулина
Синтез соматотропина (гормона роста или ГР).
Соматотропин секретируется передней долей гипофиза. Впервые он был выделен (и очищен) в 1963 г из гипофиза. Его недостаток приводит к заболеванию – гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза забитых на мясокомбинате животных, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости и лишь в развитых странах. Основные производители – Швеция, Италия, Швейцария и США. Молекула ГР человека состоит из 191 аминокислотного остатка.
Препарат из гипофизов боенского материала представляет собой смесь из нескольких форм. Это приводило к тому, что у 30% больных получивших препарат против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГР синтезируют методами гинетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках E. Coli, ГР содержит дополнительный остаток метионина на H2N-конце молекулы. Биосинтез гормона роста из 191 аминокислотного остатка был впервые осуществлён в 1979 году Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путём расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей, со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 1000 000 молекул гормона на клетку.
Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г после многолетних клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГР в клетках E. Coli и в культуре клеток животных был получен в 1984 году одновременно в институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГР, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и промышленный синтез полипептида, аналога гипоталамического релизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, таких, как карликовость (для увеличения живой массы и ускорения роста человека и животных), всех форм диабета, регенерации тканей после ожогов и др. Это происходит за счёт того что он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у человека и животных.
В селекции крупного рогатого скота перенос гена соматотропина позволяет, по оценке учёных: 1. Увеличить молочную продуктивность и живую массу животных; 2. Повысить содержание белка в молоке и мясе. Научный интерес к действию соматотропина на лактацию млекопитающих проявился ещё более 70 лет назад. Первые работы поизучению влияния соматотропина на молочную продуктивность коров были осуществлены в России ещё в 1937 г (Азимов Г., 1937). В этих исследованиях впервые было показано, что введение неочищенного экстракта из гипофиза приводит к повышению молочной продуктивности лактирующих коров на 8%. Однако сложность очистки этого гормона и весьма ограниченные возможности его производства не позволяли провести широкие исследования по изучению механизмов его действия на молочную продуктивность. И только позднее в экспериментах с использованием соматотропина крупного рогатого скота тонкой очистки было установлено, что ежедневное введение экзогенного гормона приводило к повышению надоев молока на 10-40%. Однако в этих опытах увеличение надоев молока отмечалось лишь в первые 14-16 дней (Banman D., Mc-Cutehon S., 1985).
Известно, что гормон роста, действуя на поверхностные рецепторы клетки, повышает в них синтез белка. Опыты по использованию соматотропина на молочных коровах показали, что, имеется тесная связь между действием гена этого гормона и продуктивностью. Фирма «Монсанто», которая разработала генно-инженерный способ синтеза гормона роста крупного рогатого скота доказала его эффективность (2002 г). При этом отмечается, что самый большой вклад в увеличение продуктивности может дать использование именно этого гормона. Предполагается, что в США к 2018 году этот гормон будут получать 50% коров. Наряду с усовершенствованными технологиями применение гормона позволит повысить средний удой молока от коровы к 2020 году до 9281кг и сократить число коров на 20%.
Интерферон был открыт в 1957 году в Национальном институте медицинских исследований в Лондоне, как факторы устойчивости к вирусной инфекции. Было установлено, что клетки животных, подвергнутых воздействию вируса, выделяют в среду фактор, способный придавать свежим клеткам устойчивость к вирусной инфекции. Он препятствовал (интерферировал) размножению вирусов в клетке и, в силу этой способности, был назван интерфероном.
Известны три группы интерферонов:
1. α (альфа-интерфероны, α-И), образующиеся при воздействии вирусов на лейкоциты;
2. β (бета-интерфероны, β-И), появляющиеся при воздействии вирусов на фибробласты;
3. λ (гамма-интерфероны, λ-И), продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусными антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Все интерфероны (кроме α-И) гликопротеины; они представляют собой типичные глобулярные белки, причём на долю а-спиральных структур приходится от 40 до 75%. В α-И обнаружены две дисульфидные связи. Интерфероны низкомолекулярные белки из 146 -166 аминокислотных остатков; видоспецифичны.
К числу наиболее хорошо исследованных интерферонов следует отнести α-интерфероны; число генов их кодирующих примерно 20. λинтерферон в отличие от гетерогенного класса α-интерферонов представлен всего одним индивидуальным белком, который кодируется одним геном. Менее ясна ситуация в отношении β-интерферонов. Выделен только один белок, соответствующий β-интерферону – интерферон β1; ему соответствует практически вся противовирусная активность, обнаруживаемая после индукции фибробластов. Не исключено, что в геноме существует ряд генов, кодирующих различные β-интерфероны. Интерфероны – это как бы первая линия обороны против инфекции.
Интерфероны широко используются для лечения различных тяжёлых заболеваний – острого вирусного гепатита, рассеянного склероза, остеосаркомы, миеломы, ряда опухолей гортани, лёгких и мозга.
С учётом видоспецифичности интерферонов, предназначенных для лечения, необходимы такие препараты, которые получены из клеток человека и животных. Традиционно их извлекают из крови человека и животных (из 1 л крови можно выделить всего 1 мкг интерферона, т. е. одну дозу для инъекции). До последнего времени бόльшая часть мирового производства интерферонов осуществлялась в Финляндии и Франции. С 1990 года одна из японских компаний наладила производство лимфобластоидного интерферона из лимфобластоидных клеток. С этой целью культура данных клеток индуцировалась вирусом Сендай, после чего интерферон выделяли с помощью хроматографических колонок, заполненных моноклональными антителами против получаемого интерферона. В Швеции лабробласты выращивали в ферментёрах объёмом 2000 л; полученные интерфероны очищали с помощью моноклональных антител.
Из всех видов интерферонов для мирового производства наиболее пригоден β-И. Фибробласты, получаемые из тканей плода, можно поддерживать в культуре клеток, что даёт возможность массового производства. Метод получения β-интерферона был разработан в Англии.
Выше перечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата. На современном этапе наиболее перспективный метод – биосинтез интерферонов с помощью генетически сконструированных микроорганизмов. Однако использование генно-инженерных технологий для получения интерферонов сопряжено с рядом трудностей. Они заключаются в том, что в смеси м-РНК, кодирующих различные белки, содержание кодирующих интерферон чрезвычайно мало – всего 0,1%. Тем не менее, ДНК, полученные обратным траскрибированием, были клонированы в E. Coli (рис. 8.33). Это явилось революционным событием в теоретических и прикладных исследованиях интерферонов. Метод состоит из следующих элементов:
1. Ген интерферона от человека встраивают в векторную ДНК; 2. Присоединяют к нему бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке (рис. 8.33).
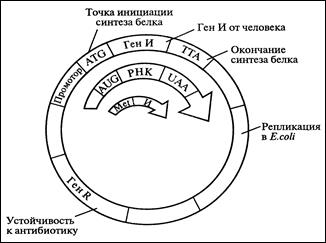
Рис. 8.33. Схема рекомбинантной плазмиды,
Биосинтез соматотропина и других гормонов человека. Получение интерферонов
Биосинтез соматотропина и других гормонов человека
Гормон роста человека, или соматотропин, синтезируется в головном мозге человека в передней доли гипофиза. Впервые он был выделен из трупного материала и очищен в 1963 г. При недостатке соматотропина развивается гипофизарная карликовость, частота встречаемости которой оценивается от 7 до 10 случаев на миллион человек.
Гормон обладает видовой специфичностью, т. е. в отличие от инсулина гормоны роста животных не имеют активности в организме человека. Следовательно, единственным средством излечения гипофизарной карликовости является гормон гипофиза, который выделяли из трупов. Исследования показали, что при внутримышечном введении соматотропина в дозах 10 мг на 1 кг массы в течение года по три инъекции в неделю дает увеличение роста примерно на 8-18 см в год.
Больные дети четырех-пяти лет при непрерывном лечении догоняли в росте своих сверстников к половой зрелости (14-16 лет). Если учесть тот факт, что из одного трупа можно получить 4-6 мг соматотропина, то можно понять, что лечение этого заболевания природным соматотропином – дело совершенно безнадежное. Помимо недостатка препарата возникли и другие проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала.
Существовала также опасность, что гипофизарный материал заражен медленно развивающимися вирусами. Такие вирусы обладают необычайно длительным инкубационным периодом, поэтому дети, получавшие препарат, нуждались в многолетнем медицинском наблюдении.
Гормон роста человека, синтезированный в специально сконструированных клетках бактерий, имеет очевидные преимущества: он доступен в больших количествах, его препараты являются биохимически чистыми и свободны от вирусных загрязнений.
Биосинтез соматотропина (состоящего из 191-го аминокислотного остатка) специально сконструированными бактериями на основе кишечной палочки был осуществлен фирмой «Генентек». Поскольку при синтезе ДНК на и-РНК получается ген, кодирующий предшественник соматотропина, не расщепляющийся в бактериальных клетках с образованием активного гормона, то поступили следующим образом: на 1 этапе клонировали двунитевую ДНК-копию и-РНК и расщеплением рестрикционными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, кроме 23-х первых аминокислот. Затем клонировали синтетический полинуклеотид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединили вместе и «подстроили» в плазмиду E. coli, после чего клетки бактерии начали синтезировать этот гормон.
К 1980 г. были закончены клинические испытания препарата и тесты на токсичность и были начаты массовые эксперименты на детях, близких по возрасту к половой зрелости. Результаты были обнадеживающими, и синтетический соматотропин с 1982 г. начал производиться в промышленном масштабе.
Еще один гормон, в-эндорфин – опиат мозга, состоящий из 31-й аминокислоты, – был синтезирован в генетически сконструированных клетках кишечной палочки. В 1980 г. австралийский ученый Шайн и американские ученые Феттес, Лэн и Бакстер успешно клонировали ДНК, кодирующую в-эндорфин, в клетках E. ooli и получили этот полипептид в виде слитного белка с ферментом в-галактозидазой. На первом этапе они клонировали фрагмент ДНК, полученный в результате обратной транскрипции и-РНК, кодирующей в-эндорфин, и далее встраивали его в плазмиду E .coli за геном в-галактозидазы, при этом получили гибридный белок, состоящий из в-галактозидазы и в-эндорфина; далее ферментативно отщепляли в-галактозидазу, получая биологически активный в-эндорфин.
Получение интерферонов
Еще одним замечательным достижением генной инженерии является синтез интерферона.
Впервые интерферон был получен в 1957 г. в Национальном институте медицинских исследований вблизи Лондона. Это белок, который выделяется в очень низких количествах клетками животных и человека при попадании в организм вирусов и направлен на борьбу с ними. Первые же исследования выявили высокую биологическую активность интерферона при лечении гриппа, гепатита и даже раковых заболеваний (подавляет размножение аномальных клеток).
Интерферон, как и соматотропин, обладает видовой специфичностью: интерфероны животных неактивны в организме человека и даже отторгаются им.
В организме человека вырабатывается несколько видов интерферонов: лейкоцитарный (а), фибробластный (Р) и иммунный (у) (Т-лимфоцитарный).
Природные интерфероны получают из крови человека с крайне низким выходом: в 1978 г. в Центральной лаборатории здравоохранения в Хельсинки (в то время мировой лидер в получении лейкоцитарного интерферона) из 50-ти тысяч литров крови было получено 0,1 г чистого интерферона.
Процесс получения интерферонов в основных чертах был одинаков для всех типов клеток, выращиваемых в культурах и образующих интерферон. Клетки крови заражали вирусом Сендай и через 24 ч фильтровали на суперцентрифуге. В надосадочной жидкости содержался грубый препарат интерферона, который подвергали хроматографической очистке.
Стоимость препарата была очень велика – 400 г интерферона стоил 2,2 млрд долларов. Однако перспективность фармакологического его использования (в том числе против четырех видов рака) заставляла искать новые пути его получения, в первую очередь с помощью генной инженерии.
В январе 1980 г. был получен интерферон человека в генетически сконструированных клетках кишечной палочки. Исходная трудность при этих методах заключалась в том, что и-РНК интерферонов мало даже в лейкоцитах, стимулированных заражением вирусов, и в том, что выходы были очень низкие: сообщалось о получении 1-2 молекул интерферона на одну бактериальную клетку.
В 1981 г. фирме «Генентек» удалось сконструировать рекомбинантную ДНК, кодирующую у-интерферон, и ввести ее в геном бактерий, дрожжей и даже клетки млекопитающих, и они стали способными синтезировать интерферон с большим выходом – 1 л культуры клеток дрожжей содержал 1 млн единиц интерферона (единица интерферона соответствует такому его количеству, которое защищает 50 % клеток в культуре от заражения вирусом). Процесс был осуществлен следующим образом: исследователи выделили смесь молекул и-РНК из лимфоцитов человека, получили молекулы соответствующих ДНК-копий и ввели их в клетки E. coli. Далее были отобраны бактерии, продуцирующие интерферон.
Получение иммуногенных препаратов и вакцин
Другая область применения генной инженерии связана с получением новых эффективных, безопасных и дешевых вакцин.
Вакцины – одно из самых значительных достижений медицины, их использование к тому же чрезвычайно эффективно с экономической точки зрения. В последние годы разработке вакцин стали уделять особое внимание. Это обусловлено тем, что до настоящего времени не удалось получить высокоэффективные вакцины для предупреждения многих распространенных или опасных инфекционных заболеваний.
Повышенный интерес к вакцинам возник после того, как была установлена роль патогенных микроорганизмов в развитии тех заболеваний, которые ранее не считали инфекционными. Например, гастриты, язва желудка и двенадцатиперстной кишки, злокачественные новообразования печени (вирусы гепатита В и С).
Поэтому в последние 10-15 лет правительства многих стран стали принимать меры, направленные на интенсивную разработку и производство принципиально новых вакцин.
Используемые сегодня вакцины можно разделить в зависимости от методов их получения на следующие типы:
– живые аттенуированные вакцины;
– инактивированые вакцины;
– вакцины, содержащие очищенные компоненты микроорганизмов (протеины или полисахариды);
– рекомбинантные вакцины, содержащие компоненты микроорганизмов, полученные методом генной инженерии
Технологию рекомбинантных ДНК применяют также для создания живых ослабленных вакцин нового типа, достигая аттенуации путем направленной мутации генов, кодирующих вирулентные протеины возбудителя заболевания. Эту же технологию используют и для получения живых рекомбинантных вакцин, встраивая гены, кодирующие иммуно-генные протеины, в живые непатогенные вирусы или бактерии (векторы), которые и вводят человеку.
Принцип применения ДНК-вакцин заключается в том, что в организм пациента вводят молекулу ДНК, содержащую гены, кодирующие иммуногенные белки патогенного микроорганизма. ДНК-вакцины называют иначе генными или генетическими.
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного протеина какого-либо микроорганизма, встраивают в бактериальную плазмиду. Кроме гена, кодирующего вакцинирующий протеин, в плазмиду встраивают генетические элементы, которые необходимы для экспрессии («включения») этого гена в клетках эукариотов, в том числе человека, для обеспечения синтеза белка. Такую плазмиду вводят в культуру бактериальных клеток, чтобы получить большое количество копий.
Затем плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Очищенная молекула ДНК и служит вакциной. Введение ДНК-вакцины обеспечивает синтез чужеродных протеинов клетками вакцинируемого организма, что приводит к последующей выработке иммунитета против соответствующего возбудителя. При этом плазмиды, содержащие соответствующий ген, не встраиваются в ДНК хромосом человека.
ДНК-вакцины обладают рядом преимуществ по сравнению с традиционными вакцинами:
– способствуют выработке антител к нативной молекуле вирусных протеинов;
– способствуют выработке цитотоксических Т-лимфоцитов;
– могут избирательно воздействовать на различные субпопуляции Т-лимфоцитов;
– способствуют формированию длительного иммунитета;
– устраняют риск инфицирования.
Получение соматотропина человека
Как известно, получение генноинженерного гормона роста человека (соматотропина человека, СТГ) было предусмотрено целевой комплексной программой по биотехнологии.
Первоначально программа складывалась при обстоятельствах, не внушавших оптимизма и радужных надежд. Прежде всего, соматотропин не выглядел на фоне других лечебных препаратов особенно перспективным. Ему трудно было конкурировать с таким лечебным средством, как интерферон, с его притязанием на лечение любых вирусных инфекций и рака и, следовательно, на широчайшее применение. Но, в конце концов, программа по соматотропину положила начало биотехнологии гипофизарных гормонов, их получению с помощью технологии рекомбинантных ДНК; и в этом заключается ее скромная, но полезная роль.
Говорили, что препарат природного гормона производится в достаточном количестве из гипофизов трупов. И, действительно, еще в 1972 г. был разработан способ получения природного гормона, и он был реализован на Каунасском заводе эндокринных препаратов. Но достаточно ли получаемого количества препарата для удовлетворения всех нужд? Это зависит от показаний для его применения. Инициаторы программы предпочитали, может быть, сознательно не углубляться в этот вопрос и довольствоваться такими расчетами. Абсолютное показание – случаи гипофизарного нанизма, заболевания редкого. Если справедлива статистика Великобритании, нанизм этого класса встречается с частотой 100 на 1000000 жителей, то в СССР таких больных будет примерно 25000. Для их лечения ежегодно требуется 7-8 кг препарата (если считать 12 ME в неделю на каждого больного при непрерывном курсе лечения) – немалое количество, оправдывающее биотехнологическое производство препарата. Но, видимо, при наличии препарата (притом более дешевого) расширятся и показания. Таковыми могут быть некоторые другие формы отставания в росте, ранения, ожоги и переломы. Стоимость генноинженерного препарата ниже, хотя исходное сырье для природного препарата почти ничего не стоит, а биотехнологический процесс имеет определенную, хотя и невысокую стоимость.
Затем в качестве аргумента против программы по соматотропину указывали на то, что его уже получили в США. И это, действительно, так.
В ноябре 1985 г. появилось сообщение, что мальчик Джеральд Флаггс 11 лет в течение года получал генноинженерный препарат соматотропина человека и за год подрос на 12,5 см. Сейчас препараты “Протропин” Генёнтека и “Соматонорм” Каби Витрум допущены к продаже.
Но не следует думать, что с получением генноинженерного соматотропина человека и, если все будет благополучно, с его допущением в клинику закончатся исследования, непосредственно с ним связанные или возникшие на параллельных путях.
Останутся проблемы, связанные с производительностью штаммов-продуцентов, их стабильностью в производственных условиях, с выделением препарата. Все может быть изменено и, вероятно, во многом улучшено.
В конце концов, совершенно необязательно получать соматотропин с помощью Е. сoli, могут быть для этого использованы иные бактерии, дрожжи, другие эукариотные клетки, животные – трансгенный кролик, трансгенная овца. В связи с этим можно вспомнить трансгенных мышей Пальмитера и Бринстера, в зиготы которых был перенесен гибридный ген металлотионеина и гормона роста крысы. Мыши-носители этого гена отличались крупными размерами и высоким содержанием соматотропина в сыворотке крови. Последнее дало основание авторам высказать мнение, что трансгенные животные могут быть использованы для получения полезных продуктов.
Но изучение гормона роста, и вообще группы соматотропина-пролактина, порождает много проблем физиологического и клинического плана, где вмешательство генетической инженерии внесет полезный вклад. К таким проблемам относится, например, множественность форм соматотропина человека: Скайлер и др. обнаружили 12 электрофоретических вариантов соматотропина. Сохранил ли этот факт свое значение и на сегодняшний день? Следует заметить, что генноинженерный соматотропин электрофоретически гомогенен.
Физиологически соматотропин человека полифункционален: помимо действия на рост костной системы, он влияет на белковый, жировой и углеводный обмен. Отсюда вытекает естественное предположение о возможности существования разобщенных структурных центров, детерминирующих соответствующие функции.
К этой проблеме имеет непосредственное отношение белковая инженерия, и первые шаги в отношении соматотропина человека уже сделаны.
Один из вопросов будущих исследований и разработок проблемы соматотропина человека касается всей сложной системы эндокринных факторов, в которую входит соматотропин в качестве одного из компонентов и которая начинается с пептидов гипоталамуса (соматостатина и рилизинг фактора СТГ) и завершается соматомединами (или как их теперь предпочитают называть – инсулиноподобными факторами роста).
Рост – полигенный процесс, и поэтому соматотропин – лишь один из многих ростовых факторов. Было важно для планирования будущих исследований и разработок иметь представление (если хотите, иметь своего рода заказ от физиологов и клиницистов), какие из этих факторов им нужны в первую очередь. Факторы этого рода могли бы быть получены посредством техники рекомбинантных ДНК, и таким образом появилась бы возможность системной терапии отклонений роста и, может быть, нарушений обмена.
Генетическая инженерия – новый этап создания лекарственных средств: мы действительно находимся на новом этапе. Сумеем ли мы быстро и эффективно использовать все выгоды ситуации, зависит и от наших усилий и от многих обстоятельств, от нас не зависящих. Но сама по себе генетическая инженерия не способна создать чуда, потому что ее возможности в значительной мере зависят, если иметь в виду область полипептидных гормонов, от достижений биохимиков, физиологов и клиницистов, которые должны рассматривать себя как элементы коллективного мозга единого организма.
“Получение соматотропина человека” и другие статьи из раздела Гормон роста
Гормон роста человека. Механизм биологической активности и перспективы применения в медицинской практике. Микробиологический синтез. Конструирование продуцентов
№4
Совершенствование биообъектов методами клеточной инженерии. Гибридомы. Значение гибридом для производства современных диагностических препаратов.
Клеточная инженерия – это метод конструирования клеток нового типа на основе их культивирования, гибридизации и реконструкции, базирующийся на использовании методов культуры клеток и тканей. Выделяют два направления развития клеточной инженерии:
использование клеток, переведенных в культуру, для синтеза различных соединений;
применение культивируемых клеток для получения из них растений-регенератов.
Растительные клетки в культуре – это важный источник ценнейших природных веществ, т.к. они сохраняют способность синтезировать свойственные им соединения: алкалоиды, эфирные масла, смолы, биологически активные вещества и т.п. Например, клетки женьшеня, переведенные в культуру, продолжают синтезировать, как и в составе целостного растения, ценное лекарственное сырье. Причем в культуре с клетками легче проводить любые манипуляции, используя индуцированный мутагенез, можно повышать продуктивность штаммов культивируемых клеток и проводить их гибридизацию гораздо проще, чем на уровне целостного организма. Кроме того, с ними, как и с прокариотическими клетками, можно проводить генно-инженерные работы.
Таким образом, клеточная инженерия позволяет конструировать клетки нового типа, комбинировать отдельные фрагменты клеток (ядра, митохондрии, пластиды, цитоплазму и хромосомы и т.п.), соединять клетки различных видов, относящиеся не только к разным родам, семействам, но и царствам.
Клеточная инженерия широко используется в селекции растений. Выделены гибриды томата и картофеля, яблони и вишни. Регенерированные из таких клеток растения с измененной наследственностью позволяют синтезировать новые формы, сорта, обладающие новыми свойствами и устойчивые к неблагоприятным условиям среды и болезням. Этот метод широко используется и для «спасения» ценных сортов, пораженных вирусными болезнями.
биотехнология Воронин с99-100.
Гибридомная технология.
Было предпринято множество попыток отыскать способы получения антител с узкой специфичностью. Так, при определенных условиях иммунизации бактериальными полисахаридами удается получить высокоиммуногенный препарат антител с узкой специфичностью, но большинство попыток оказались безуспешными. Высокоспецифические антитела были получены, когда антителообразующие клетки перенесли в организм летально облученных животных и из селезенки извлекали локальные зоны, содержащие очаги пролиферации одного клона иммунных лимфоцитов. Эти клоны продуцировали в сущности моноклональные антитела, но их можно было выделить в очень незначительных количествах. Данные опыты имели лишь теоретическое значение для оценки числа клонов и не давали препаративного способа получения моноклональных антител.
В 1975 г. Д. Келер и Ц. Милштейн предложили принципиально иной метод получения гомогенных антител. Они осуществляли слияние плазмацитомы с клетками селезенки иммунизированного животного, получив, таким образом, гибридомы, которые унаследовали от опухолевых клеток способность неограниченно размножаться, а от клеток селезенки – синтезировать антитела предопределенной специфичности. Этот метод очень быстро получил широкое распространение во всем мире (Д. Келер и Ц. Милштейн в 1984 г. получили Нобелевскую премию).
Предпосылками для создания гибридомной технологии были ранее разработанные методы:
1) получение миелом и адаптация их культивирования вне организма;
2) соматическая гибридизация;
3) получение селективных культуральных сред.
Образование и отбор гибридных клеток
Первый шаг в процессе получения гибридной клеточной линии, продуцирующей антитела одного типа, состоит во введении мышам специфического антигена. После ряда иммунизации, проведенных в течение нескольких недель, проверяют, произошло ли развитие у животных иммунного ответа. Если ответ развился, то животных умерщвляют, извлекают селезенку, промывают ее, измельчают и несильно встряхивают для высвобождения единичных клеток, среди которых находятся и антителопродуцирующие β-клетки. Взвесь клеток селезенки смешивают со взвесью миеломных клеток, дефектных по гипоксантин-гуанин- фосфорибозилтрансферазе (HGPRT – ). Комбинированную взвесь в течение нескольких минут инкубируют в 35%-ном полиэтиленгликоле, а затем переносят в среду, содержащую гипоксантин, аминоптерин и тимидин (среда ГАТ).
Обработка полиэтиленгликолем облегчает слияние клеток, тем не менее слияние происходит редко и является в достаточной степени случайным событием. В смеси присутствуют клетки миеломы, селезенки, а также слившиеся слетки миеломы – селезенки, миеломы – миеломы, селезенки – селезенки. Однако в среде ГАТ растут только гибридные клетки миеломы -селезенки, все остальные типы клеток не могут в ней пролиферировать. Клетки селезенки и слившиеся клетки селезенки – селезенки вообще нe растут в культуре, а миеломные клетки НGPRT – и слившиеся клетки миеломы – миеломы не могут использовать гипоксантин в качестве предшественника в процессе биосинтеза пуриновых оснований гуанина и аденина, без которых невозможен синтез нуклеиновых кис-лот. Но у них есть другой естественный путь синтеза пуринов – при участии дигидрофолатредуктазы, поэтому в состав среды и входит аминоптерин, ингибирующий активность этого фермента. Таким образом, миеломные клетки
HGPRT – и слившиеся клетки миеломы – миеломы не могут синтезировать пурины в среде ГАТ и погибают.

Слившиеся клетки селезенки – миеломы растут в среде ГАТ, поскольку:
1) клетки селезенки поставляют функциональную HGPRT, которая может утилизировать экзогенный гипоксантин среды несмотря на блокирование синтеза пуринов с участием дигидрофолатредуктазы аминоптерином;
2) клетки миеломы способны активно делиться. Тимидин необходим для устранения блокирования в синтезе пиримидинов, обусловленного ингибирова-нием дигидрофолатредуктазы. На 10 – 14-е сутки после слияния клеток в среде ГАТ остаются и растут только слившиеся клетки селезенки – миеломы. Их затем вносят в лунки пластиковых микротитровальных плашек и выращивают на полной культуральной среде без ГАТ.
Гормон роста человека. Механизм биологической активности и перспективы применения в медицинской практике. Микробиологический синтез. Конструирование продуцентов.
Гормон роста (соматотропный гормон, СТГ) – белок, секретируемый у позвоночных передней долей гипофиза. Наличие его в экстрактах из гипофиза было отмечено ещё в 1921г. Г.Эвансом и Дж. Лонгом, однако лишь в 1944г он был получен в виде очищенного препарата, а через несколько лет после этого (1948) – в кристаллическом состоянии. В зависимости от вида животного (бык, овца, свинья, крыса) молекулярная масса кристаллического препарата гормона роста колеблется от 20 до 22кДа. В гипофизе человека содержится от 4 до 10мг СТГ. В течение суток синтезируется 1-2мг гормона роста, период его полураспада составляет 21мин. Около 90% секретируемого в гипофизе гормона роста имеет молекулярную массу 2кДа, а остальное количество приходится на гормон с молекулярной массой 20кДа. В последнем отсутствует участок полипептидной цепи, содержащей 15 аминокислотных остатков в положении 32-46.Молекула гормона роста человека состоит из 191 аминокислотного остатка. Ген, ответственный за синтез СТГ человека, локализован на длинном плече 17-й хромосомы. Первичная структура гормона выяснена Ч.Ли и сотр. (1969) и уточнена Г.Найлом с сотр. (1973). Гормон роста обладает широким спектром биологической активности. Помимо ростостимулирующего действия СТГ обнаруживает гипергликемическое, липотропное или жиромобилизующее действие. За каждую данную функцию в молекуле соматотропина отвечает определенный участок аминокислотной последовательности. Гормон роста обладает ярко выраженным анаболическим действием и влияет на все клетки организма, повышая в них уровень биосинтетических процессов. Усиливает биосинтез белков, ДНК, РНК и гликогена, способствует мобилизации жиров из жировых депо и ускоряет распад высших жирных кислот. СТГ улучшает функцию почечных канальцев и нормализует минеральный и водный обмен организма. Исследования на молекулярном уровне показали, что СТГ стимулирует деятельность РНК-полимераз и полирибосомного аппарат клетки. Как свидетельствуют опыты с меченым фосфором, самым ранним эффектом действия гормона является синтез в ядрах клеток предшественников мРНК и рРНК. Вместе с тем велико его влияние и на проницаемость клеточных стенок, так как фонд внутриклеточных аминокислот в присутствии СТГ значительно возрастает, что способствует новообразованию белков. Возможно, первопричиной всех этих явлений служит всё же активирование мембранно-связанной аденилатциклазы. Вместе с тем показано, что СТГ повышает в крови особых стимулирующих рост факторов – соматомединов – белков с молекулярной массой примерно 7кДа. Механизм их действия активно изучается. Снижение секреции гормона роста наблюдается при гипергликемии и повышении уровня свободных жирных кислот в крови. СТГ высвобождается пульсирующим способом, выброс гормона происходит через каждое 3-5ч, а пик его секреции приходится на ночное время (через 1-4часа от начала сна).
Общего количества фармацевтического препарата, выпускаемого компаниями крупных производителей СТГ, хватало для лечения лишь одной трети случаев гипофизарной карликовости в развитых странах; недостаток соматотропина оказался ещё более острым с учетом других случаев его применения (незаживающие переломы, ожоги, язвы, нару 1 шение гемопоэза).
К тому же возникли проблемы, связанные с гетерогенностью гормона, выделяемого из трупного материала. Несмотря на совершенствование выделения и очистки гормона, у 5% больных, получавших препарат, вырабатывались антитела, которые сводили на нет его биологическую активность. Кроме того, гипофизарный материал заражён нейро-токсическим вирусом с необычайно длительным инкубационным периодом, поэтому дети, получавшие СТГ, нуждались в многолетнем медицинском наблюдении. Вирус, содержавшийся в препаратах СТГ, нередко приводил к летальному исходу. С 1985 г. ВОЗ запрещено применение гормона, выделяемого из человеческих гипофизов.
Рекомбинантный соматотропин, получивший название соматрем, стал вторым (после человеческого инсулина) биосинтетическим фармацевтическим препаратом. СТГ, биологически чистый и свободный от вирусных загрязнений, впервые был получен в 1980 г. фирмой «Genen-tech». Гормон, синтезированный в генетически сконструированных клетках кишечной палочки, отличается от гормона, выделенного из гипофиза, дополнительным остатком метионина на NН2-конце молекулы (гормон обладает биологической активностью нативного гормона и даже большим эффектом, чем гормон роста из гипофиза, по-видимому, по причине большей чистоты). У детей, страдающих гипофизарной карликовостью, зарегистрирован прирост 8-18 см в год, что несколько больше эффекта гормона, полученного из гипофиза. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестрикцион-ными эндонуклеазами получили последовательность, которая кодирует всю аминокислотную последовательность гормона, за исключением первых 23 аминокислот. Затем клонировали синтетический полипептид, соответствующий аминокислотам от 1-й до 23-й. Далее два фрагмента объединяли, затем «подстроили» к паре промоторов (промотор — специфическая последовательность в ДНК, необходимая для инициации транскрипции РНК-полимеразы) и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры Е. coli (100000 молекул гормона на клетку). СТГ, синтезированный в бактериях, обладал нужной м.м. и не связан с каким-либо бактериальным белком, от которого его необходимо было бы отщеплять.
Изменяя аминокислотную последовательность СТГ, т.е. его первичную структуру, посредством модификации кодирующего его гена, в бактериальных клетках можно синтезировать аналоги гормона, очень важные для изучения активных участков молекулы (например, участков, которые стимулируют рост или оказывают действие на неоглюко-генез) и этиологии карликовости на молекулярном уровне.
Используя методы рекомбинантных ДНК, можно синтезировать и другие факторы роста и факторы дифференцировки тканей, выделив вначале их мРНК, затем получив соответствующие гены. Это относится к соматомедину А, стимулирующему фиксацию серы в хряще, образование которого индуцируется соматотропином.
В 1982 г. выделен и синтезирован полипептид, содержащий из 44 аминокислотных остатков, обладающий полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение СТГ-РФ способно компенсировать недостаток соматотропина. Применение СТГ-РФ возможно не только для лечения гипо-физарной карликовости, но и при некоторых формах диабета и для ускорения регенерации тканей у людей, получивших сильные ожоги.
Дата добавления: 2018-04-04 ; просмотров: 544 ;