Наследственная предрасположенность к онкологическим заболеваниям. Анализ гена BRCA1 (ген рака молочной железы) Анализ на выявление генетической расположенности к раку
Анализ генов BRCA1 и BRCA2 для выявления синдрома наследственного рака молочной железы и яичника
Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ). Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome). Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.


На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
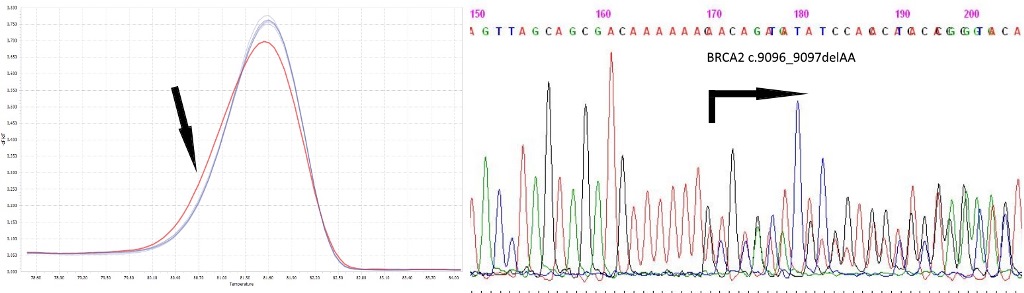
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.

Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.



Авторская публикация:
АЛЕКСАХИНА СВЕТЛАНА НИКОЛАЕВНА,
лаборант-исследователь научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Передается ли рак по наследству?

Рекомендации:
Вы наверняка не раз задавались этим вопросом, если у кого-то из ваших родственников обнаруживали онкологическое заболевание. Многие люди теряются в догадках – что делать, если бабушки и прабабушки умирали в 30-40 лет, а никакой информации об их заболеваниях нет? А если они умирали в 60 «по старости», как и все в то время, была ли это онкология? Может ли она возникнуть у меня?
Когда родственник заболевает раком, нам страшно. В какой-то мере страшно и за свое здоровье – передается ли рак по наследству? Прежде чем делать поспешные выводы и впадать в панику, давайте разберемся с этим вопросом.
Мы в клинике «Медицина 24/7» стараемся активно применять достижения генетиков в повседневной практике: определяем предрасположенность к различным видам рака и наличие мутаций – с помощью генетических исследований. Если вы входите в группу риска – о ней мы расскажем чуть позже – вам стоит обратить внимание на эти исследования. А пока – вернемся к вопросу.
По своей сути, рак – генетическое заболевание, которое возникает вследствие поломки генома клетки. Раз за разом в клетке происходит последовательное накопление мутаций, и она постепенно приобретает свойства злокачественной – малигнизируется.

Генов, которые участвуют в поломке, несколько, и перестают работать они не одновременно.
- Гены, кодирующие системы роста и деления, называются прото-онкогенами. При их поломке клетка начинает бесконечно делиться и расти.
- Есть гены-супрессоры опухолей, отвечающие за систему восприятия сигналов от других клеток и тормозящие рост и деление. Они могут сдерживать рост клетки, а при их поломке этот механизм выключается.
- И, наконец, есть гены репарации ДНК, кодирующие белки, которые чинят ДНК. Их поломка способствуют очень быстрому накоплению мутаций в геноме клетки.
Генетическая предрасположенность к онкологии
Существует два сценария возникновения мутаций, вызывающих онкологические заболевания: ненаследственный и наследственный. Ненаследственные мутации появляются в изначально здоровых клетках. Они возникают под воздействием внешних канцерогенных факторов, например, курения или ультрафиолетового излучения. В основном рак развивается у людей в зрелом возрасте: процесс возникновения и накопления мутаций может занимать не один десяток лет.
Однако, в 5-10% случаев предопределяющую роль играет наследственность. Происходит это в том случае, когда одна из онкогенных мутаций появилась в половой клетке, которой посчастливилось стать человеком. При этом каждая из примерно 40*1012 клеток организма этого человека также будет содержать начальную мутацию. Следовательно, каждой клетке нужно будет накопить меньше мутаций, чтобы стать раковой.
Повышенный риск развития рака передается из поколения в поколение и называется наследственным опухолевым синдромом. Встречается данный синдром довольно часто – примерно у 2-4% населения.
Несмотря на то, что основную массу онкологических заболеваний вызывают случайные мутации, наследственному фактору также необходимо уделять серьезное внимание. Зная об имеющихся унаследованных мутациях, можно предотвратить развитие конкретного заболевания.
Предрасположенность к раку наследуется как Менделевский доминантный признак, иными словами, как обычный ген с различной частотой возникновения. При этом вероятность возникновения в раннем возрасте у наследственных форм выше, чем у спорадических.
Распространенные генетические исследования
Коротко расскажем вам об основных видах генетических исследований, которые показаны людям из группы риска. Все эти исследования можно провести в нашей клинике.
Определение мутации в гене BRCA
В 2013 году благодаря Анджелине Джоли весь мир активно обсуждал наследственный рак молочной железы и яичников, о мутациях в генах BRCA1 и BRCA2 теперь знают даже неспециалисты. Из-за мутаций теряются функции белков, кодируемых этими генами. В результате основной механизм репарации (восстановления) двунитевых разрывов молекулы ДНК нарушается, и возникает состояние геномной нестабильности – высокой частоты мутаций в геноме клеточной линии. Нестабильность генома является центральным фактором канцерогенеза.
Учеными описано более тысячи различных мутаций в этих генах, многие из которых (но не все) связаны с повышенным риском возникновения онкологического заболевания.
У женщин с нарушениями в BRCA1/2 риск заболеть раком молочной железы составляет 45-87%, в то время как средняя вероятность этого заболевания – всего 5,6%. Растет вероятность развития злокачественных опухолей и в других органах: яичниках (с 1 до 35%), поджелудочной, а у мужчин – и в предстательной железе.
Генетическая предрасположенность к наследственному неполипозному колоректальному раку (синдром Линча)
Колоректальный рак – одно из самых распространенных онкологических заболеваний в мире. Около 10% населения имеет генетическую предрасположенность к нему.
Генетический тест на синдром Линча, также известного как наследственный неполипозный колоректальный рак (НПКР), определяет заболевание с точностью 97%. Синдром Линча – наследственное заболевание, в результате которого злокачественная опухоль поражает стенки толстого кишечника. Считается, что около 5% всех случаев колоректального рака связаны с этим синдромом.
Определение мутации в гене BRaf
При наличии меланомы, опухолей щитовидной или предстательной железы, опухоли яичников или кишечника рекомендуется (а в некоторых случаях обязательно) проведение анализа на BRaf мутацию. Это исследование поможет выбрать необходимую стратегию лечения опухоли.
BRAF – это онкоген, который отвечает за кодировку белка, располагающегося в сигнальном пути Ras-Raf-MEK-MARK. Этот путь, в норме, регулирует деление клеток под контролем фактора роста и различных гормонов. Мутация в онкогене BRaf приводит к избыточному неконтролируемому разрастанию и устойчивости к апоптозу (запрограммированной смерти). Результатом является в несколько раз ускоренное размножение клеток и рост новообразования. По показаниям данного исследования специалист делает заключение о возможности использования ингибиторов BRaf, которые продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией.

Методика проведения анализа
Любой генетический анализ – сложная многоэтапная процедура.
Генетический материал для анализа берут из клеток, как правило, из клеток крови. Но в последнее время лаборатории переходят на неинвазивные методы и иногда выделяют ДНК из слюны. Выделенный материал подвергается секвенции – определению последовательности мономеров при помощи химических анализаторов и реакций. Эта последовательность и является генетическим кодом. Полученный код сравнивают с эталонным и определяют, какие участки относятся к тем или иным генам. На основании их наличия, отсутствия или мутации делают заключение о результатах теста.
Сегодня в лабораториях множество методов генетического анализа, каждый из них хорош в тех или иных ситуациях:
- FISH–метод (fluorescence in situ hybridization ). В полученный от пациента биоматериал вводят специальный краситель – ДНК-пробу с флуоресцентными метками, которые способны показать хромосомные аберраций (отклонения), значимые для определения наличия и прогноза развития некоторых злокачественных процессов. Например, метод удобен при определении копий гена HER-2, важного признака при лечении рака молочной железы.
- Метод сравнительной геномной гибридизации (CGH). Метод позволяет сравнить ДНК здоровой ткани пациента и ткани опухоли. Точное сравнение дает понять, какие именно участки ДНК повреждены, а это дает инструменты для выбора целенаправленного лечения.
- Секвенирования нового поколения (NGS) – в отличие от более ранних методов секвенирования, «умеет читать» сразу несколько участков генома, поэтому успоряет процесс «чтения» генома. Применяется для определения в определенных участках генома полиморфизмов (замена нуклеотидов в цепи ДНК) и мутаций, связанных с развитием злокачественных опухолей.
За счет большого количества химических реактивов процедуры генетических исследований достаточно финансово затратные.. Мы стараемся устанавливать оптимальную стоимость всех процедур, поэтому цена на такие исследования у нас начинается от 4 800 рублей.
Группы риска
В группы риска по наследственному раку попадают люди, у которых наблюдается хотя бы один из перечисленных факторов:
- Несколько случаев одного вида рака в семье
(например, рак желудка у деда, отца и сына); - Заболевания в раннем для данного показания возрасте
(например, колоректальный рак у пациента моложе 50 лет); - Единичный случай определенного вида рака
(например, рак яичников, или трижды негативный рак молочной железы); - Рак в каждом из парных органов
(например, рак левой и правой почки); - Больше одного типа рака у родственника
(например, сочетание рака молочной железы и рака яичников); - Рак, нехарактерный для пола пациента
(например, рак молочной железы у мужчины).
Если для человека и его семьи характерен хотя бы один фактор из списка, то следует получить консультацию у врача-генетика. Он определит, есть ли медицинские показания для того, чтобы сдавать генетический тест.
Чтобы обнаружить рак на ранней стадии, носителям наследственного опухолевого синдрома следует проходить тщательный скрининг на онкологические заболевания. В некоторых случаях риск развития рака можно существенно снизить с помощью превентивных операций и лекарственной профилактики.
Генетический «вид» раковой клетки в процессе развития изменяется и теряет свой первоначальный вид. Поэтому, чтобы использовать молекулярные особенности рака для лечения, недостаточно исследовать только наследственные мутации. Для выявления слабых мест опухоли нужно провести молекулярное тестирование образцов, полученных в результате биопсии или операции.
При проведении теста опухоль анализируется, составляется индивидуальный молекулярный паспорт. В комплексе с анализом крови, в зависимости от требуемого теста, проводится комбинацирование различных анализов на геном и белок. В результате данного теста появляется возможность назначения таргетной терапии, эффективной для каждого типа имеющейся опухоли.
Профилактика
Бытует мнение, что для определения предрасположенности к раку можно сделать простой анализ на наличие онкомаркеров – специфических веществ, которые могут быть продуктами жизнедеятельности опухоли.
Повышение показателя может зависеть от целого ряда причин, совершенно не связанных с онкологическими заболеваниями. В то же время, есть примеры людей с онкологическими заболеваниями, у которых значения онкомаркера оставались в пределах нормы. Специалисты используют онкомаркеры как метод для отслеживания протекания уже обнаруженного заболевания, результаты которого нужно перепроверять.
Для выявления вероятности генетической наследственности в первую очередь, если вы входите в группу риска, нужно обратиться за консультацией к врачу-онкологу. Специалист, исходя из вашего анамнеза, сделает вывод о необходимости проведения тех или иных исследований.
Важно понимать, что решение о проведении какого-либо теста должен принять именно врач. Самолечение в онкологии неприемлемо. Неправильно интерпретированные результаты не только могут вызвать преждевременную панику – вы попросту можете упустить наличие развивающегося онкологического заболевания. Выявление рака на ранней стадии при наличии вовремя поставленного правильного лечения дает шанс на выздоровление.
Стоит ли паниковать?
Рак – неизбежный спутник долгоживущего организма: вероятность накопления соматической клеткой критического числа мутаций прямо пропорциональна времени жизни. То, что рак – генетическое заболевание, не значит, что оно наследственное. Он передается в 2-4% случаев. Если у вашего родственника обнаружили онкологическое заболевание – не впадайте в панику, этим вы навредите и себе, и ему. Обратитесь к врачу-онкологу. Пройдите исследования, которые он вам назначит. Лучше, если это будет специалист, который следит за прогрессом в области диагностики и лечения рака и в курсе всего, что вы сами только что узнали. Следуйте его рекомендациям и не болейте.
Ген рака молочной железы 1 (BRCA1). Выявление мутации 4153delA (нарушение структуры белка)
Маркер связан с особенностями восстановления ДНК при повреждениях, участвует в поддержании стабильности генома. Исследуется для выявления наследственной предрасположенности к раку молочной железы и яичников.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Название гена – BRCA1
Локализация гена на хромосоме – 17q21.31
Функция гена
Ген BRCA1 кодирует белок BRCA1 (breast cancer 1), участвующий в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании генетической стабильности.
Мутация гена BRCA1
Мутация заключается в делеции (утрате) одного нуклеотида – А (аденин) в позиции 4153 последовательности ДНК гена BRCA1 и обозначается как 4153delA.
Возможные генотипы
Ассоциация маркера с заболеваниями
- Рак молочной железы
- Рак яичников
Общая информация об исследовании
BRCA1 играет важную роль в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании стабильности генома. Ген BRCA1, кодирующий белок BRCA1, является геном-супрессором опухоли, в норме защищающим клетку от злокачественного перерождения. При возникновении мутации в этом гене значительно повышается вероятность развития рака молочной железы (РМЖ) и яичников (РЯ).
BRCA1 имеет множество мутантных аллелей. Мутация, заключающаяся в делеции (утрате) нуклеотида аденина в позиции 4153, обозначается как 4153delA. Делеция инактивирует работу гена, что в итоге может увеличивать вероятность развития РЯ и РМЖ. Данная мутация и мутация 5382insC являются причиной почти 86 % семейного рака яичников в России.
Рак молочной железы и яичников – одни из самых распространенных онкологических заболеваний. Присутствие мутаций в гене BRCA1 может увеличить вероятность рака молочной железы более чем в 5 раз, а рака яичников – в 10-28 раз. Средний возраст развития заболевания при этом снижается до 25-30 лет. Чем старше человек, тем выше у него вероятность рака.
Выявленные семейные случаи заболевания в первую очередь свидетельствуют о наследственной природе рака и требуют генетического анализа. Ген BRCA1 участвует в защите организма от спонтанных повреждений ДНК, поэтому нарушение его работы позволяет накапливаться мутациям и приводит к онкологическим заболеваниям, и в первую очередь – к раку молочной железы и яичников. Известно, что рак, ассоциированный с генетическими маркерами BRCA, характеризуется высокой степенью злокачественности и выраженной лимфоидной инфильтрацией.
Анализ можно проводить в любом возрасте, и при раннем выявлении нарушений по указанному маркеру лечение будет начато своевременно.
Для успешного лечения онкологических заболеваний очень важно обнаружить опухоль на ранней стадии, еще до появления симптомов. Поэтому генетическая предрасположенность к раку молочной железы и яичников – серьезное показание к регулярному обследованию в целях выявления заболевания на ранней стадии.
Интерпретация результатов
- N/N – популяционный риск развития рака молочной железы и яичников
- N/del – высокий риск развития рака молочной железы и яичников
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Диагностическая значимость
Поскольку данный ген может иметь несколько мутантных вариантов, необходимо оценивать его работу одновременно по нескольким маркерам.
Изолированное исследование мутации 4153delA рекомендуется только при выявлении данного маркера у родственников первой степени родства.
Генетический маркер входит в исследование:
![]()
Генетическое тестирование рака молочной железы
Рак молочной железы (РМЖ) является наиболее распространенным онкологическим заболеванием среди женского населения. Ежегодно во всем мире регистрируется около 1 700 000 новых случаев возникновения рака груди и более 500 000 смертей. Около 10% от общего количества случаев РМЖ наследуется по аутосомно-доминатному типу. Большинство наследственных случаев связаны с мутациями двух генов: BRCA1 (ген BReast CAncer one) и BRCA2 (ген BReast CAncer two). У каждого из нас есть гены BRCA1 и BRCA2, их функция заключается в репарации повреждения ДНК и поддержании нормального роста клеток молочной железы. При наличии в этих генах мутации значительно повышается риск развития РМЖ, однако, это не означает, что он будет у вас диагностирован. Действительно, у женщин с верифицированным диагнозом рака молочной железы и мутацией генов BRCA1, или BRCA2, зачастую имеется семейный анамнез рака груди, яичников и других видов рака. Но тем не менее, большинство людей, у которых развивается РМЖ не имеют к нему генетической предрасположенности.

Кому необходимо проводить анализ на генетическую предрасположенность к раку молочной железы?
Женщинам, входящим в группу риска развития РМЖ, а именно, если:
- Имеются близкие родственницы (бабушка, мать, сестра, тетя) у которых рак груди был диагностирован до 50 лет
- В нескольких поколениях семи был рак молочной железы или яичников
- Есть родственница с трижды негативным раком молочной железы
- В семье помимо рака груди, имеются и другие виды онкологических заболеваний, например, рак простаты, поджелудочной железы, желудка, матки, щитовидной железы, толстой кишки, а также меланома, или саркома.
- Среди родственниц был случай двустороннего или мультифокального рака молочной железы
- РМЖ был выявлен в возрасте до 35 лет
- Имеется рак грудной железы у родственника-мужчины
- Известно о наличии в семье мутации генов BRCA1 и/или BRC A2
Стоит повторить, что если у одного члена семьи имеется генетическая мутация, связанная с развитием рака молочной железы, это еще не означает, что все остальные члены семьи будут ее иметь.
Имеются данные о возникновении РМЖ при наличии мутации следующих генов: ATM, BARD1, BRIP1, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, STK11, TP53.
Перед проведением генетического тестирования на наличие мутаций в вышеперечисленных генах настоятельно рекомендуется посетить консультацию врача-генетика. «Положительный» результат анализа говорит о том, что вы входите в группу риска развития РМЖ, но не означает, что он у вас уже имеется. При низкой вероятности обнаружения мутации генов BRCA1, BRCA2 и других вышеперечисленных, не рекомендуется проводить генетическое тестирование.
Как проводят генетическое тестирование
Генетическое тестирование на определение риска развития рака молочной железы может оказать существенное влияние на жизнь людей, поэтому перед проведением ис следования необходимо подписать информированное согласие, которое включает в себя описание преимуществ и недостатков теста. Основным преимуществом тестирования является знание о наличии, или отсутствии мутации. Генетическое тестирование проводится путем забора венозной крови без предварительной подготовки. Сроки выдачи результатов в коммерческих лабораториях составляют 2-4 недели, в исследовательских центрах – не менее 4 недель. После получения результатов теста важно, чтобы врач-генетик интерпретировал результаты и обсудил их с вами. Положительный результат теста означает, что пациент является носителем мутации в исследованном гене. Отрицательный результат не исключает наличия мутации в других генах, вызывающих РМЖ и возможность его возникновения. Результаты анализа также могут быть неопределенными, это означает, что в гене обнаружена мутация, но нет данных о наличии ее влияния на развитие РМЖ.
Интересные факты и статистика:
- Мутация гена BRCA1 случается чаще, чем мутация BRCA2.
- У носителей BRCA1-мутаций, страдающих РМЖ, риск возникновения рака второй молочной железы в 1,6 раза выше, чем у носителей BRCA2-мутаций.
- Среднестатистический риск развития рака молочной железы составляет 12%, а при мутации генов BRCA1 и BRCA2 риск возрастает до 40%-85%.
- Риск развития рака яичников также возрастает с 2% до 16-44%.
- Молодой возраст (до 35 лет) на момент выявления первой опухоли связан с более высоким риском развития рака второй молочной железы у пациенток с мутацией в гене BRCA1.
- Наследование двух аномальных копий генов BRCA2, BRIP1, MRE11A, NBN, PALB2, RAD50 и RAD51C вызывает анемию Фанкони, которая приводит к угнетению всех ростков кроветворения.
- В России при РМЖ помимо мутации генов BRCA1 и BRCA2, распространена мутация гена CHEK2 (не менее 2%).
Что делать здоровым носительницам мутаций?
- Обследование молочных желёз у маммолога начиная с 25 лет раз в 6 месяцев
- Маммография с 25 лет раз в 6-12 месяцев
- Магнитно-резонансная томография грудной клетки с 25 лет раз в 6-12 месяцев
- Самообследование молочных желёз с 18 лет ежемесячно
- Профилактическая мастэктомия после 35 лет, разрешенная в Европе, однако не проводится в Российской Федерации
- Профилактическая овариэктомия после 40 лет, также разрешенная в Европе, однако не проводится в Российской Федерации без доказательства наличия патологических клеток
- Регулярная сдача анализа на онкомаркер СА125
Пройти генетическое тестирование или записаться на консультацию к врачу-генетику и получить всю необходимю информацию в Москве можно в Центре семейной генетики FG Lab (Family genetics laboratory) .
Использованная литература:
- Dunning A. M. et al. A systematic review of genetic polymorphisms and breast cancer risk //Cancer Epidemiology and Prevention Biomarkers. – 1999. – Т . 8. – №. 10. – С. 843-854.
- Имянитов Е. Н. Наследственный рак молочной железы //Практическая онкология. – 2010. – Т. 11. – №. 4. – С. 258-266.
- Rahman N., Stratton M. R. The genetics of breast cancer susceptibility //Annual review of genetics. – 1998. – Т . 32. – №. 1. – С. 95-121.
- Pharoah P. D. P. et al. Family history and the risk of breast cancer: a systematic review and meta ‐ analysis //International journal of cancer. – 1997. – Т . 71. – №. 5. – С. 800-809.
- https://www.nationalbreastcancer.org
На платформе Vikids вы можете:








