Недоношенные дети. Недоношенность – описание, причины, симптомы (признаки), лечение P54 Другие неонатальные кровотечения
Недоношенные дети
Недоношенные дети – это дети, родившиеся ранее срока родов, функционально незрелые, с массой ниже 2500 г и длиной тела менее 45 см. Клинические признаки недоношенности включают непропорциональное телосложение, открытые швы черепа и малый родничок, невыраженность подкожно-жирового слоя, гиперемию кожных покровов, недоразвитие половых органов, слабость или отсутствие рефлексов, слабый крик, интенсивную и длительную желтуху и др. Выхаживание недоношенных детей подразумевает организацию специального ухода – температурного режима, влажности, уровня оксигенации, вскармливания, при необходимости – проведение интенсивной терапии.

Общие сведения
Недоношенными считаются дети, рожденные в период с 28 по 37 неделю беременности, имеющие массу тела 1000-2500 г и длину тела 35-45 см. Наиболее устойчивым критерием считается срок гестации; антропометрические показатели, в силу их значительной вариабельности, относятся к условным критериям недоношенности. Ежегодно в результате самопроизвольных преждевременных родов или искусственно индуцированного прерывания беременности на поздних сроках недоношенными появляются на свет 5-10% детей от общего числа новорожденных.
По определению ВОЗ (1974 г.), плод считается жизнеспособным при гестационном сроке более 22 недель, массе тела от 500 г, длине тела от 25 см. В отечественной неонатологии и педиатрии рождение плода ранее 28 недели гестации, имеющего массу тела менее 1000 г и длину менее 35 см расценивается как поздний выкидыш. Однако, если такой ребенок родился живым и прожил после рождения не менее 7 суток, он регистрируется как недоношенный. Уровень неонатальной смертности среди недоношенных детей намного выше такового среди доношенных младенцев, и в значительной мере зависит от качества оказания медицинской помощи в первые минуты и дни жизни ребенка.

Причины недоношенности
Все причины, приводящие к рождению недоношенных детей можно объединить в несколько групп. К первой группе относятся социально-биологические факторы, включающие слишком юный или пожилой возраст родителей (моложе 18 и старше 40 лет), вредные привычки беременной, недостаточное питание и неудовлетворительные бытовые условия, профессиональные вредности, неблагоприятный психоэмоциональный фон и др. Риск преждевременного родоразрешения и рождения недоношенных детей выше у женщин, не планировавших беременность и пренебрегающих медицинским сопровождением беременности.
Вторую группу причин составляет отягощенный акушерско-гинекологической анамнез и патологическое течение настоящей беременности у будущей мамы. Здесь наибольшее значение имеют аборты в анамнезе, многоплодие, гестозы, гемолитическая болезнь плода, преждевременная отслойка плаценты. Причиной рождения недоношенных детей могут служить непродолжительные (менее 2-х лет) интервалы между родами. Нередко недоношенные дети рождаются у женщин, прибегающих к экстракорпоральному оплодотворению, однако это связано не с самим фактом использования ВРТ, а скорее – с «женским» фактором, препятствующим оплодотворению естественным путем. Неблагоприятно на вынашивании беременности сказываются гинекологические заболевания и пороки развития гениталий: цервицит, эндометрит, оофорит, фиброма, эндометриоз, двурогая седловидная матка, гипоплазия матки и др.
К третьей группе причин, нарушающих нормальное созревание плода и обуславливающих повышенную вероятность рождения недоношенных детей, относятся различные экстрагенитальные заболевания матери: сахарный диабет, гипертоническая болезнь, пороки сердца, пиелонефрит, ревматизм и др. Часто преждевременные роды провоцируются острыми инфекционными заболеваниями, перенесенными женщиной на поздних сроках гестации.
Наконец, рождение недоношенных детей может быть связано с патологией и аномальным развитием самого плода: хромосомными и генетическими болезнями, внутриутробными инфекциями, тяжелыми пороками развития.
Классификация недоношенности
С учетом обозначенных критериев (срока гестации, массы и длины тела) выделяют 4 степени недоношенности:
I степень недоношенности – родоразрешение происходит на сроке 36-37 недель гестации; масса тела ребенка при рождении составляет 2500-2001 г, длина – 45-41 см.
II степень недоношенности – родоразрешение происходит на сроке 32-35 недель гестации; масса тела ребенка при рождении составляет 2001-2500 г, длина – 40-36 см.
III степень недоношенности – родоразрешение происходит на сроке 31-28 недель гестации; масса тела ребенка при рождении составляет 1500-1001 г, длина – 35-30 см.
IV степень недоношенности – родоразрешение происходит ранее 28 недель гестации; масса тела ребенка при рождении составляет менее 1000 г, длина – менее 30 см. В отношении таких детей используется термин «недоношенные с экстремально низкой массой тела».
Внешние признаки недоношенности
Для недоношенных детей характерен ряд клинических признаков, выраженность которых коррелирует со степенью недоношенности.
Глубоко недоношенные дети, имеющие массу тела
Недоношенность – описание, причины, симптомы (признаки), лечение.
Краткое описание
Недоношенность — состояние плода, рождённого до окончания нормального периода внутриутробного развития (до истечения 37 нед гестации), с массой тела менее 2 500 г, ростом менее 45 см, характеризующееся несовершенством терморегуляции, склонностью к асфиксии, недостаточной сопротивляемостью к воздействию факторов окружающей среды. Учитывая индивидуальную вариабельность показателей, не исключена условность антропометрических критериев недоношенности. Частота — 5–10% новорождённых.
Классификация по массе тела • I степень — 2 001–2 500 г • II степень — 1 501–2 000 г • III степень — 1 001–1 500 г • IV степень — менее 1000 г.
Причины
Этиология • Со стороны матери •• Заболевания почек, ССС, эндокринные нарушения, острые инфекционные заболевания, гинекологическая патология •• Осложнения беременности — гестоз •• Внутриматочные контрацептивы •• Травмы, в т.ч. психические •• Интоксикации — курение, употребление алкоголя и наркотиков •• Иммунологическая несовместимость (резус – конфликт, конфликт по группам крови) •• Юный или пожилой возраст матери •• Производственные вредности • Со стороны отца •• Хронические заболевания •• Пожилой возраст • Со стороны плода •• Генетические заболевания •• Эритробластоз плода •• Внутриутробные инфекции.
Симптомы (признаки)
Клиническая картина • Диспропорциональное строение тела — большая голова с преобладанием мозгового отдела черепа над лицевым • Открытые черепные швы, кости черепа податливые, ушные раковины мягкие • Толстый слой сыровидной смазки, обильное пушковое оволосение • Слабое развитие подкожной жировой клетчатки, несовершенство терморегуляции • Гипотония мышц, поза лягушки • У мальчиков яички не опущены в мошонку, у девочек большие половые губы не прикрывают малые • Слабо выраженные физиологические рефлексы новорождённых (сосательный, поисковый, хватательный, Моро, автоматической ходьбы) • Дыхание поверхностное, ослабленное, ЧДД 40–54 в минуту, периодические эпизоды апноэ • Пульс лабилен, слабого наполнения, ЧСС 120–160 в минуту, низкое АД (среднее АД 55–65 мм рт.ст.) • Срыгивание • Транзиторный гипотиреоз • Учащённое мочеиспускание.
Лечение
ЛЕЧЕНИЕ
• Недоношенных детей выхаживают в специальной палате с температурой воздуха 25 °С при влажности 55–60%. Индивидуальные условия создают с помощью кувезов или дополнительного обогрева кроватки. Кувезы закрытого типа используют в первые дни жизни для выхаживания детей с массой тела 2 кг и менее.
• Здоровых недоношенных детей выписывают домой при достижении массы тела 2 кг, но не ранее, чем на 8–10 – е сутки.
• Здоровых недоношенных детей, не достигших в первые 2 нед жизни массы тела 2 кг, и больных независимо от массы тела переводят на второй этап выхаживания •• В стационар второго этапа выхаживания детей переводят в специально оснащённых реанимационных машинах с кувезом и подачей кислорода •• В специализированных отделениях детей размещают в боксированных палатах. Глубоко недоношенных и больных детей выхаживают в кувезах •• Купание здоровых недоношенных начинают с 2 – недельного возраста (при эпителизации пупочной ранки), при массе тела менее 1000 г гигиенические ванны начинают со 2 – го месяца жизни •• Прогулки проводят с 3–4 – недельного возраста при достижении массы тела 1700–1800 г •• Выписывают здоровых детей из отделения второго этапа выхаживания при достижении массы тела 1700 г.
• Вскармливание •• Вскармливание сцеженным грудным молоком матери (или донорским) при отсутствии противопоказаний и большом сроке гестации начинают через 2–6 ч после рождения. Общая схема энтерального кормления: сначала проба с дистиллированной водой, затем несколько введений 5% р – ра глюкозы с нарастающим объёмом, при хорошей переносимости глюкозы — грудное молоко •• Парентеральное питание с помощью назогастрального или орогастрального зонда показано незрелым и находящимся в тяжёлом состоянии детям в первые 24–48 ч жизни •• Прикладывание к груди проводят по индивидуальным показаниям, при активном сосании и массе тела 1800–2000 г •• Объём одного кормления в первые сутки составляет 5–10 мл, во 2 – е сутки — 10–15 мл, в 3 – и сутки — 15–20 мл •• Расчёт питания проводят по калорийности ••• Первые 3–5 дней — 30–60 ккал/кг/сут ••• К 7–8 – му дню — 60–80 ккал/кг/сут ••• К концу первого месяца — 135–140 ккал/кг/сут ••• С 2 мес детям, родившимся с массой тела более 1500 г, калорийность снижают до 135 ккал/кг/сут ••• Детям с меньшей массой тела калорийность сохраняют на уровне 140 ккал/кг/сут до 3 мес •• Суточная потребность в пищевых ингредиентах зависит от вида вскармливания ••• Естественное вскармливание (грудным нативным или пастеризованным молоком): первые 6 мес: белок — 2,2–2,5 г/кг, жиры — 6,5–7 г/кг, углеводы 12–14 г/кг; второе полугодие: белок — 3–3,5 г/кг, жиры — 5,5–6 г/кг ••• Смешанное и искусственное вскармливание: белок соответственно 3–3,5 и 3,5–4 г/кг; калорийность повышают на 10–15 ккал/кг •• Общий суточный объём жидкости: 87,5% объёма приходится на молоко, остальной объём составляют питьё (смесь [1:1] р – ра Рингера с 5% р – ром глюкозы) и внутривенные инфузии ••• К концу первой недели жизни общий суточный объём жидкости равен 70–80 мл/кг при массе тела менее 1500 г и 80–100 мл/кг при массе более 1500 г ••• К 10 – му дню жизни — 125–130 мл/кг ••• К 15 – му дню жизни — 160 мл/кг ••• К 20 – му дню — 180 мл/кг ••• К 1–2 мес — 200 мл/кг •• Введение витаминов ••• В первые 2–3 дня жизни — менадиона натрия бисульфит по 0,001 г 2–3 р/сут для профилактики геморрагических нарушений ••• Аскорбиновая кислота по 30–100 мг/сут, тиамин, рибофлавин ••• Витамин Е — 5% р – р по 2–5 капель/сут в течение 10–12 дней ••• Специфическая профилактика рахита ••• При выраженной незрелости и тяжёлой сопутствующей патологии — пиридоксин, витамины В5, В15 и липоевая кислота •• При отсутствии материнского или донорского молока со 2 – й недели применяют адаптированные молочные смеси — Новолакт – ММ, Премалалак, Препилтти и др. •• Сроки введения прикормов определяют индивидуально.
Течение и прогноз • Выживаемость зависит от срока гестации и массы тела при рождении •• При III–IV степени недоношенности и менее 30–31 нед гестации роды заканчиваются рождением живого ребёнка в 1% случаев •• При интенсивном лечении возможно выживание детей со сроком гестации 22–23 нед • Смертность возрастает при наличии факторов риска •• Кровотечение у матери перед родами •• Многоплодная беременность •• Роды при тазовом предлежании •• Перинатальная асфиксия •• Мужской пол плода •• Гипотермия •• Респираторный дистресс – синдром.
Сопутствующая патология • Агенезия, аплазия, гипоплазия, ателектазы лёгких • Респираторный дистресс – синдром • Эритробластоз плода • Ретинопатия недоношенных • Анемия недоношенных • Синдром Вильсон–Микити • Дисбактериоз • Кишечные инфекции • Пневмония • Омфалит.
МКБ-10 • P05 Замедленный рост и недостаточность питания плода
Недоношенный ребенок: причины, лечение, уход

Недоношенный ребенок – это родившийся до 37 недель.
Полный срок беременности составляет 40 нед. Младенцы, родившиеся до 37 нед, имеют повышенную частоту осложнений и смертность, примерно пропорциональные степени недоношенности. Преждевременные роды встречаются примерно в 12,5% беременностей в США и являются одной из основных причин заболеваемости и смертности новорожденных. Частота недоношенности для черных детей составляет 17,9%.
Ранее всех младенцев массой
По медицинской статистике большее число преждевременных родов происходит весной и зимой, летом и осенью они случаются гораздо реже.
Физиологические особенности недоношенного ребенка
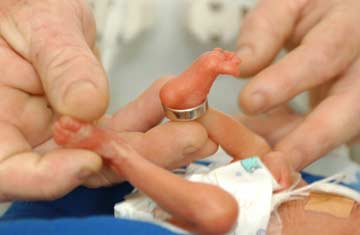
Внешне малыш, появившийся на свет раньше срока, заметно отличается от доношенных новорожденных. Такие дети обычно очень худенькие. Голова недоношенного ребенка кажется непропорционально большой, а ручки и ножки — очень маленькими и тонкими, на его стопах и ладошках еще не видно линий, а ногти могут быть недостаточно развиты.
Его кожа очень тонкая и нежная, сквозь нее сильно просвечивают кровеносные сосуды, поэтому она может казаться ярко-красной. Плечи, спину и лицо младенца покрывают волоски. Пупочное кольцо на распластанном животике располагается ниже, чем у доношенных новорожденных, кости головы кажутся совсем мягкими, а роднички довольно большие. Ушные раковины очень тонкие и мягкие. Нередко у недоношенных мальчиков не происходит опускание яичек в мошонку.
Такой малыш мало двигается по сравнению с доношенным ребенком, его активность и мышечный тонус заметно снижены, рефлексы менее выражены. В состоянии глубокой недоношенности (при появлении малыша на свет на сроке беременности менее 32 недель) может наблюдаться полное отсутствие жизненно важных рефлексов. Дыхание его может быть очень слабым и нерегулярным, вдохи и выдохи часто чередуются с паузами.
Ребенок, родившийся восьмимесячным, скорее всего, будет в состоянии дышать самостоятельно, а вот шестимесячному крохе может понадобиться подключение к аппаратуре искусственного дыхания.
Поскольку система терморегуляции у недоношенных детей развита очень плохо, они нуждаются в создании специальных условий. Их подкожный жировой слой еще практически не сформирован, а поверхность тела по отношению к его массе очень велика — такой ребенок не в состоянии самостоятельно поддерживать оптимальную температуру своего организма и очень быстро переохлаждается. Более зрелых малышей вполне достаточно укрывать потеплее, тогда как самым маленьким потребуется помещение в кувез, в котором постоянно будет поддерживаться температура 31—34°.
Кувез, нередко называемый «инкубатором», дает возможность создать для малыша, появившегося на свет раньше срока, условия, приближенные к условиям пребывания в теле матери. Постоянная температура, стерильность, помощь аппаратуры в питании и дыхании ребенка помогут ему дозреть и научиться жить в этом новом для него мире. Пребывание в кувезе может длиться всего несколько дней, а может и растянуться на месяцы. Но, так или иначе, наступит день, когда вы сможете прижать своего малыша к груди!
Когда ваш малыш будет готов к жизни вне искусственно созданной среды, вы сможете забрать его домой.
Симптомы и признаки недоношенного ребенока
Выражено маленькое количество подкожного жира, небольшое количество волос или маленький хрящ наружного уха. Спонтанная активность и тонус снижаются, и конечности не поддерживаются в согнутом положении, типичном для доношенных детей. У мальчиков мошонка может иметь несколько складок, а яички быть неопущенными. У девочек большие половые губы еще недостаточно покрывают малые половые губы. Рефлексы развиваются в разное время в течение беременности. Рефлекс Моро формируется на 28-32-й нед и хорошо выражен на 37-й. Ладонный рефлекс появляется с 28-й нед и хорошо выражен на 32-й. Тонический рефлекс шеи начинается на 35-й нед и наиболее заметен на первом месяце последнего триместра.
Диагностика недоношенного ребенка
Симптомы при медосмотре коррелируют со сроком гестации. Предполагаемая дата родов и пренатальное УЗИ, если проводилось, также определяют срок беременности.
Первоначальное тестирование. Наряду с соответствующим тестированием на любые выявленные проблемы или расстройства рутинная оценка включает пульсоксиметрию, содержание в сыворотке кальция и электролитов, полный анализ крови, уровень билирубина, посев крови, оценку слуха, УЗИ черепа для выявления внутрижелудочкового кровоизлияния и перивентрикулярной лейкомаляции и скрининг у офтальмолога на выявление ретинопатии недоношенных. Вес, длина и окружность головы должны быть нанесены на соответствующую диаграмму роста с интервалом в неделю.
Последующий скрининг. Недоношенных детей нужно проверить на наличие апноэ и брадикардии, пока они не достигнут 34,5-35 нед скорректированного возраста. Перед выпиской из больницы недоношенные дети должны пройти мониторинговую оценку автокресла с использованием пульсоксиметрии, чтобы убедиться, что они могут поддерживать проходимость дыхательных путей и достаточную Oj во время пребывания в автокресле. После выписки недоношенные дети должны пройти обследование на предмет нервного развития и получить соответствующее направление на интервенционные программы, необходимые для восстановительного лечения и реабилитации.
Осложнения недоношенного ребенока
Большинство осложнений относится к дисфункции незрелых систем органов. В некоторых случаях осложнения полностью проходят, в других имеются остаточные органные дисфункции.
Легкие. Производство сурфактанта часто недостаточно для предотвращения альвеолярного коллапса и ателектазов, которые приводят к респираторному дистресс-синдрому. Для профилактики используется терапия. Несмотря на эту терапию, у многих недоношенных детей развивается хроническая форма болезни легких, известная как бронхолегочная дисплазия с длительной необходимостью ИВЛ и дополнительной (^-терапии.
ЦНС. Младенцы, рожденные на сроке беременности менее 34 нед, имеют недостаточную координацию рефлексов сосания и глотания, и их нужно кормить парентерально или через зонд. Незрелость дыхательного центра в стволе мозга приводит к приступам апноэ (центральное апноэ), которое также может быть результатом только гипофарингеальной обструкции (обструктивное апноэ). Оба варианта могут присутствовать.
Перивентрикулярный зародышевый матрикс (масса эмбриональных клеток на боковой стенке боковых желудочков; присутствует только у плода) склонен к образованию кровоизлияний, которые могут распространяться в желудочки мозга (внутрижелудочковые кровоизлияния). Инфаркт перивентрикулярного белого вещества (перивентрикулярная лейкомаляция) также может проявляться по причинам, которые не полностью понятны. Гипотония, нарушение или нестабильность перфузии головного мозга и пики АД (при быстром внутривенном введении жидкости или коллоидного раствора) могут способствовать развитию церебрального инфаркта или кровоизлияний. Повреждение перивентрикулярной белой субстанции – основной фактор риска развития церебрального паралича и задержек нервного развития.
У недоношенных детей, особенно с сепсисом, гипоксией и внутрижелудочковым или перивентрикулярным кровоизлиянием в анамнезе, имеется риск развития когнитивных задержек. Эти дети требуют тщательного последующего наблюдения в течение первого года жизни для выявления слуховых, зрительных и нервной задержек развития. Обращают внимания на основные этапы развития, мышечный тонус, антропометрические данные (вес, длина и окружность головы) и речевое развитие. Младенцев с проблемами зрения следует направить к детскому офтальмологу. Детей со слуховой и нервной задержкой (в т.ч. повышенным мышечным тонусом и аномальными защитными рефлексами) следует направить на ранние интервенционные вмешательства, которые обеспечивают физическую, трудовую и логопедическую терапию. Младенцев с тяжелой неврологической проблемой, возможно, нужно будет направить к детскому неврологу.
Инфекция. Сепсис или менингит примерно в 4 раза чаще возникают у недоношенных детей. Повышенная заболеваемость является результатом установки длительных внутрисосудистых катетеров и эндотрахеальной трубки, наличия участков разрушения кожных покровов.
Сердце. Артериальный проток чаще всего не закрыт после рождения у недоношенных новорожденных. Распространенность открытого артериального протока (PDA) возрастает с увеличением недоношенности; открытый артериальный проток имеет место почти у половины младенцев массой
Недоношенный ребенок
В 1961 году экспертная группа ВОЗ в целях уточнения демографической статистики и планирования программ здоровья для детей с низкой массой тела при рождении рекомендовала придерживаться следующих определений:
1. Недоношенными считать детей, родившихся при сроках беременности до полных 37 недель, доношенными – родившихся при сроках 38-42 недели и переношенными – при сроках более 42 недель.
2. Относить всех детей с массой тела при рождении 2, увеличение рСОг, снижение рН. На рентгенограммах легких выявляется характерная нодозно-ретикулярная сетка, полосовидные тени ателектазов, в динамике нарастающая завуалированность легочных полей вплоть до картины «белых легких» и «воздушной бронхограммы».
Факторы риска развития синдрома дыхательных расстройств: недоношенность более 5—6 недель, длительная внутриутробная гипоксия, сахарный диабет и анемия у беременной, кесарево сечение, второй ребенок из двойни, мужской пол плода.
Риск увеличивается при уменьшении массы тела ребенка при рождении. Так, у детей с массой тела 1000 г относительный риск синдрома дыхательных расстройств составил 39,3, при массе тела от 1000 до 1500 г – 8,8, при массе тела 1500—2000 г – 4,5 и при массе выше 2000 г – 1,4.
Аналогичная зависимость существует и от гестационного возраста. Относительный риск при сроке беременности 31 — 34 недели равен 21,5, а при сроке 35—37 нед. — 3,3.
Оценка по шкале Апгар, отражающая наличие гипоксии у новорожденного, также коррелирует с риском развития синдрома дыхательных расстройств. Величина относительного риска развития данного синдрома при оценке по шкале Апгар менее 7 баллов на 1 и 5 минутах жизни составляет 7,9 и 8,4 соответственно.
Хотя рождение ребенка путем кесарева сечения является одним из факторов, способствующих развитию синдрома дыхательных расстройств, относительный риск его невелик по сравнению с риском под влиянием других факторов и составляет 1,8 (Luerti M. et al., 1993).
Риск развития этого синдрома у новорожденных, родившихся у матерей с сахарным диабетом, зависит от тяжести материнского заболевания. Так, по данным И. И. Евсюковой и Н. Г. Кошелевой (1996), наибольшая частота наблюдается у детей, матери которых имели инсулинзависимый сахарный диабет и заболели в возрасте 2— 17 лет; она составила 28,1%, в том числе при тяжелой форме — 9,7%, по сравнению с 8,8 и 2% соответственно при диабете, впервые выявленном в период беременности.
Одним из значимых прогностических признаков развития синдрома дыхательных расстройств является снижение содержания фосфолипидов (основной составной части сурфактанта легких) в амниотической жидкости, определяемое по снижению коэффициента лецитин/сфингомиелин менее 2,0.
Косвенным показателем недостаточности сурфактанта может служить отрицательный «пенный тест». «Пенный тест», или проба Клементса, основан на способности легочного сурфактанта образовывать стабильную пену в присутствии этанола. Пробу амниотической жидкости или желудочного аспирата смешивают в пропорции 1 : 2 с этанолом и встряхивают в течение 15 секунд.
Если на всей поверхности смеси образуется двойной ряд пузырьков, которые сохраняются в течение 15 минут, то тест считается положительным и указывает на достаточно зрелое состояние системы сурфактанта легких. В таких случаях риск развития синдрома дыхательных расстройств отсутствует.
Отсутствие пузырьков на поверхности (отрицательный результат) указывает на недостаточность сурфактанта и высокий риск развития синдрома дыхательных расстройств, составляющий 60% (Torday J. S., Richardson D., 1991). Вероятность ошибки при отрицательном результате выше, чем при положительном.
Профилактика синдрома дыхательных расстройств в антенатальном периоде предусматривает, наряду с мероприятиями, направленными на профилактику угрозы преждевременных родов, стимуляцию процессов морфологического и функционального созревания легких. С этой целью в настоящее время рекомендуется использование кортикостероидов при угрозе преждевременных родов в сроке менее 34—35 недель. На курс назначают 8—12 мг дексаметазона: по 4 мг 2 раза в день внутримышечно в течение 2—3 дней или в таблетках по 2 мг 4 раза в день в 1-й день, по 2 мг 3 раза на 2-й день и по 2 мг 2 раза в день на 3-й день (В. М. Сиделышкова, 1995). Кроме дексаметазона, могут быть использованы: бетаметазон 6—12 мг в сутки (по 1,5 мг каждые 6 часов), гидрокортизон 100 мг в сутки и преднизолон 60 мг в • сутки в течение 2 дней. И. И. Рюминой (1996) показана эффективность использования солукортефа – препарата, содержащего гидрокортизон и янтарную кислоту, которая обладает антиоксидантным действием и является естественным метаболитом. Солукортеф назначается внутримышечно в дозе 100 мг в сутки (3 раза через 3 часа).
Антенатальная гормональная профилактика позволяет снизить частоту синдрома дыхательных расстройств у новорожденных на 30—50% и предотвратить развитие тяжелых форм заболевания (Schmidt P. L., 1984; Рюмина И. И., 1996). По данным J. Cross (1991), частота синдрома дыхательных расстройств у детей родившихся при сроке беременности менее 30 недель, при проведении профилактики матери составляет 35% вместо 60%, если таковая не проводилась, а при проведении профилактики при сроке от 30 до 34 недель — 10% вместо 25%.
Кроме кортикостероидов с целью стимуляции созревания сурфактантной системы рекомендуют применять и такие препараты, как амброксол (метаболит бромгексина), который по эффективности не уступает кортикостероидам (Luerty M. et al., 1987). Амброксол увеличивает содержание сурфактанта в легких путем усиления его синтеза и секреции в альвеолоцитах и предотвращения его разрушения.
Препарат вводится внутривенно капельно в дозе 1 г в 500 мл изотонического раствора хлорида натрия в течение 5 дней или 1 г каждые 12 часов (всего 4 раза).
При сочетании гипертензии и угрозы преждевременных родов наиболее приемлемым препаратом для профилактики синдрома дыхательных расстройств у новорожденных считается эуфиллин, который назначается беременным в виде 2,4% раствора в дозе 10 мл в 10 мл 20% раствора глюкозы в сутки внутривенно в течение 3 дней (В. М. Сидельникова, 1995).
После рождения с целью профилактики синдрома дыхательных расстройств в настоящее время используются препараты сурфактанта, искусственные или естественные (экзосурф, альвеофакт, сурванта и др.). С профилактической целью препараты сурфактанта показаны недоношенным и незрелым детям с массой тела менее 1350 г, имеющим высокий риск развития синдрома дыхательных расстройств, а также новорожденным с массой тела более 1350 г, но с подтвержденной объективными методами незрелостью легких.
Многоцентровые клинические испытания показали, что применение препаратов сурфактанта у этих детей в первые 2 часа жизни позволяют снизить частоту синдрома дыхательных расстройств, снизить в 2 раза смертность от этого заболевания, уменьшить количество детей, выживших от синдрома дыхательных расстройств без бронхолегочной дисплазии, а также уменьшить частоту возникновения таких осложнений, как пневмоторакс и интерстициальная эмфизема. Раннее профилактическое применение препаратов сурфактанта оказалось более эффективным, чем использование их с лечебной целью.