Иммунитет слизистых оболочек. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия Аббревиатура malt иммунология
Иммунитет слизистых оболочек. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия Аббревиатура malt иммунология

Барьерный (мукозальный) иммунитет
Иммунитет такая штука (на этом, как правило, точные знания о нём заканчиваются), которую все хотят поднять, так как считают, что опустится эта штука сама. Где тонко, там и рвётся!
Что это:
Микробиота – «общага» для живых бактерий, грибов и вирусов, обитающих в кишечном тракте, во всём их генетическом разнообразии (в 150 раз больше по сравнениию с геномом человека).
Антибиотики – противобактериальные препараты, но кто у нас различает бактерию и вирус? Например, из всех бронхитов максимум 15% имеют бактериальную природу, но при таком диагнозе антибиотики, как правило, назначают всем. Доводы: а вдруг чё там? Лишним не будет! Я не назначу, другой врач назначит, а я как дурак… В прошлый раз ведь помогло!
Что такое мукозальный иммунитет?
Мукозой называют внутреннюю оболочку полых органов, сообщающихся с внешней средой (желудок, кишечник, мочевой пузырь, влагалище и пр.). Её функция – защита от проникновения внешних «врагов» с помощью физического барьера, противомикробных (воспалительных) белков и иммунных ответов. Вся иммунная борьба в барьерных тканях (если прибавить сюда кожу) и будет называться мукозальный (барьерный) иммунитет.
Основные симптомы, которые появляются в начале заболевания (насморк, кашель, боль в горле, изжога, диарея, воспаление кожных покровов) и есть «бои на границе», в барьерных тканях.
В чем суть:
Каковы взаимоотношения этих «трёх поросят» – микробиоты (микрофлоры), барьерного (мукозального) иммунитета и антибиотиков?
Иммунитет слизистых реализуется через единую систему, название которой – mucosa-associated lymphoid tissue – MALT, ещё есть SALT – skin…кожа (дерма). Это половина всей иммунной системы, где на площади 400 кв.м (4 сотки) расположены 50% иммунных клеток. То есть половина всех «защитников родины» находится в приграничной зоне.
Ранее считалось, что эпидермис является непроницаемым физическим барьером, но сейчас выяснилось, что в коже и слизистых существуют специальные клетки (дендритные и М-клетки), функцией которых является контролируемый трафик чужеродных агентов через биологический барьер (кожа, слизистая). Своего рода разведчики берут «языка», переводят его через «линию фронта», выведывают его «буржуинские» тайны и обучают этим хитростям новобранцев (свежие иммунные клетки, они так и называются – наивные лимфоциты).
Кроме того, клетки кожи и слизистых включают рецепторы, которые запускают контролируемую воспалительную (атомную) реакцию с выделением цитокинов (пептиды; их 3 типа – противо- и провоспалительные, и регуляторы иммунитета). Таким образом, иммунная система барьерных тканей всё время находится в состоянии «тлеющей» активации, что позволяет при проникновении патогена давать быстрый иммунный ответ «обученными бойцами». Обучение-то они, конечно, прошли, но метко стрелять ещё не умеют – это называется адаптивный иммунитет.
Как это работает?
Его представительством в тканях (подэпителиальная, подслизистая рыхлая ткань) являются изолированные лимфоидные фолликулы, в которых находятся «бойцы», в том числе В-лимфоциты, продуцирующие IgA. Эта система «местного» иммунитета связана региональными лимфоузлами, миндалинами, пейеровыми бляшками, аппендиксом и переводит иммунный ответ с местного уровня на системный (федеральный), что позволяет вводить в действие высокоспецифические антитела (высокоточное оружие) на конкретный патоген– это называется приобретенный иммунитет. Так работают прививки и вакцины на конкретное заболевание.
Как организм новорожденного распознает, что можно «всосать», а что надо «выплюнуть»? Один из путей идет через недавно открытые сигнальные рецепторы врожденного иммунитета (signal pattern recognizing receptor – SPRR). Каждый патоген имеет «отличительный знак», так называемый патоген-ассоцированный молекулярный образ (patogen-associated molecular patterns – PAMP). Обычно это бактериальный липополисахарид или ДНК, двуспиральная РНК, глюканы грибков и другие названия подобных «образов», которые запомнить невозможно. Клетки распознают «чужаков» по этим знакам и начинают «мочить их в сортире» с помощью фагоцитоза (поглощения), продукцией активных форм кислорода, усиливая экспрессию генами провоспалительных пептидов (цитокинов). Такая реакция во многом паническая, неумелая, но на первоначальном этапе приводит к задержке «противника» на границе – это называется врождённый иммунитет.
А с какого бока-припёка здесь микрофлора? Дело в том, что внутрикишечная флора имеет «договор» с нашим организмом – мы сдаём ей в аренду площади (слизистые, кожа), взамен она помогает переваривать пищу, продуцирует витамины, а главное – защищает от патогенных микроорганизмов. Микрофлора образует биопленку на поверхности слизи, которая, как пограничный контроль, проверяет паспорта – гражданин ли ты данной страны. Кроме того, поддерживает адаптивный иммунитет в «тлеющем» состоянии (а наш бронепоезд на запасном пути), сохраняя золотую середину между иммуноагрессией/супрессией через сигнальные рецепторы врожденного иммунитета.
Как влияют антибиотики на иммунный ответ?
На экспериментальных животных и у человека в клинике многократно подтверждено, что антибиотики приводят к изменению микробиоты. Например, клиндамицин в виде 7-дневного курса почти на 2 года меняет у человека видовой состав бактерий рода Bacteroides. 5-дневный курс ципрофлоксацина приводит к изменению микробиоты у человека почти на 30%. Для частичного восстановления микробиоты после курса ципрофлоксацина требуется около месяца.
Кроме того, антибиотики «мочат» всех без разбора, и часть погибшей микрофлоры замещается патогенами – например, грибками (привет, молочница). На уровне эпителия наблюдаются снижение продукции слизи и истончение «пассивного» барьера. Одновременно уменьшается секреция противомикробных пептидов, то есть «пограничная полоса» становится уже и перебежать её легче. Рецепторы SPRR, видя такой «балаган», реагируют бурным выбросом провоспалительных агентов, а золотой (защитной) середины уже нет, и данное воспаление распространяется системно по организму, и если кто-то хоть как-то похож на «врага», по нему наносится удар (аутоимунная реакция), что может провоцировать развитие язвенного колита, болезни Крона, ревматоидного артрита, васкулитов, нейродермита и т.д.
Как помочь?
- трансплантация фекальной микробиоты (ТФМ) Промышленное масштабирование ТФМ является весьма проблематичным, и процедура сегодня используется (и, очевидно, будет использоваться) как крайняя мера, когда невозможно уничтожить патоген другими способами – например, в случае антибиотикорезистентных штаммов. В настоящее время эффективность ТФМ (80–100%) была продемонстрирована в случае инфицирования Clostridium difficile в качестве меры борьбы с псевдомембранозным колитом.
- использование пробиотиков , добавляя, что ни один из пробиотиков не может полностью воспроизвести состав нормофлоры, а значит, не способен восстановить нормальный баланс кишечной микробиоты.
- использовать минимальные биологически активные фрагменты (МБАФ) – это фрагменты патогенных микробов, а также нормофлоры, на которые реагируют рецепторы врожденного иммунитета (SPRR), стимулируя барьерный (адаптивный) иммунитет.
Что с этим делать и на что обратить внимание:
– главный вывод этой статьи: НЕФИГ назначать антибиотики направо и налево. Например, в Голландии назначить антибиотик, особенно ребёнку, целая история. Тем не менее одна из самых здоровых (и длинных) наций в Европе;
– умеренно-грязные руки у ребёнка – хорошо (но, приучать мыть после посещения туалета), отдавать в садик рано – хорошо (хоть и болеет, в среднем, раз в три недели первый год), прививки делать – хорошо. Всё это тренирует адаптивный и приобретенный иммунитет, и затем в подростковом возрасте значительно меньше аллергических и аутоиммунных заболеваний. Кстати, в США запретили производство антибактериального мыла.
Следите за своим здоровьем – будете знать, куда оно ушло!
Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия
О статье
Автор: Козлов И.Г. (ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, Москва)
В барьерных тканях (слизистые и кожа) расположена многоуровневая система защиты организма от чужеродных инфекционных и химических агентов, получившая название «мукозоассоциированная лимфоидная ткань» (МАЛТ). Она включает в себя гуморальные факторы и клетки врожденного и адаптивного иммунитета, а также неиммунные механизмы защиты. Одним из важных компонентов защиты барьерных тканей является микробиота, комменсалы которой, с одной стороны, осуществляют метаболическую функцию и прямую противопатогенную активность, а с другой — постоянно стимулируют МАЛТ на разных уровнях и, таким образом, поддерживают иммунитет барьерных тканей в состоянии «тлеющей» активации и готовности к быстрому ответу на вторжение чужеродных организмов или веществ. Антибиотики, являясь одними из наиболее часто назначаемых лекарственных препаратов, нарушают количество, состав и активность симбиотических микроорганизмов. Как следствие, происходит ослабление иммунитета барьерных тканей, что способствует заселению слизистых и кожи патогенными микроорганизмами и, в частности, их антибиотикорезистентными штаммами. Осознание этого факта требует изменения тактики назначения антибиотиков и введения дополнительных лекарственных препаратов с целью поддержания активности МАЛТ. Препаратами — кандидатами на дополнение к этиотропной противоинфекционной терапии являются паттерны симбиотических микроорганизмов (microbial-associated molecular patterns (МАМР)) или, что более реально с точки зрения фармакологии, их минимальные биологически активные фрагменты (МБАФ).
Ключевые слова: мукозальный иммунитет, микробиота, антибиотики, иммуносупрессия, инфекции, антибиотикорезистентность, иммуномодуляция, заместительная терапия.
Для цитирования: Козлов И.Г. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия // РМЖ. 2018. №8(I). С. 19-27
Microbiota, mucosal immunity and antibiotics: the fineness of the interaction I.G. Kozlov D. Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow There is a multi-level system for protecting the body from foreign infectious and chemical agents, known as «mucosa-associated lymphoid tissue» (MALT), in the barrier tissues (mucosa and skin). It includes humoral factors and cells of congenital and adaptive immunity, as well as non-immune defense mechanisms. One of the important components of protecting barrier tissues is the microbiota, whose commensals, on the one hand, carry out metabolic function and direct anti-pathogenic activity, and, on the other hand, constantly stimulate MALT at different levels and, thus, support the immunity of barrier tissues in the state of «smoldering activation” and readiness for a rapid response to the invasion of foreign organisms or substances. Antibiotics, being one of the most frequently prescribed medications, disrupt the number, composition and activity of symbiotic microorganisms. As a consequence, the immunity of barrier tissues is weakened, which contributes to the colonization of mucous and skin by pathogenic microorganisms and, in particular, their antibiotic-resistant strains. Awareness of this fact requires a change in the tactics of prescribing antibiotics and the introduction of additional medications to maintain MALT activity. Candidate drugs to supplement etiotropic anti-infective therapy are microbial-associated molecular patterns (MAMP) or, that is more real from the pharmacologycal point of view, their minimal biologically active fragments (MBAF).
Key words: mucosal immunity, microbiota, antibiotics, immunosuppression, infections, antibiotic resistance, immunomodulation, replacement therapy.
For citation: Kozlov I.G. Microbiota, mucosal immunity and antibiotics: the fineness of the interaction // RMJ. 2018. № 8(I). P. 19–27.
Обзорная статья посвящена тонкостям взаимодействия микробиоты, мукозального иммунитета и антибиотиков

Введение
Мукозальный иммунитет и сигнальные рецепторы врожденного иммунитета
На протяжении всего развития иммунологии мукозальный иммунитет (иммунитет слизистых и кожи, иммунитет барьерных тканей) привлекал внимание исследователей и особенно врачей. Это обусловлено тем, что подавляющее большинство иммунных ответов происходит именно в барьерных тканях, которые находятся под непрерывной антигенной нагрузкой вследствие попыток проникновения в организм патогенных микроорганизмов и ксенобиотиков (посторонних или чужеродных веществ с иммуногенными свойствами).
При этом вполне физиологические иммунные реакции, направленные на поддержание гомеостаза организма, почти всегда сопровождаются воспалительным ответом (собственно воспаление является неотъемлемой частью успешной реализации иммунитета) и другой негативной с точки зрения пациента симптоматикой, что приводит его к необходимости искать помощи у врача. Насморк, кашель, боль в горле, диарея и диспепсия, воспаление кожных покровов, с одной стороны, и аллергические реакции, с другой, – возникновение всех этих проблем не обходится без участия мукозального иммунитета, они являются наиболее частыми причинами обращения к врачам различных специальностей. Как ни странно, несмотря на разную локализацию и достаточно разные проявления, в основе патогенеза всех этих состояний (и многих других) лежат одни и те же механизмы активации мукозального иммунитета.
Иммунитет слизистых реализуется через единую структурированную систему, получившую название «мукозоассоциированная лимфоидная ткань» (МАЛТ) (mucosa-associated lymphoid tissue — MALT). Структуризация МАЛТ идет по этажам в зависимости от того, где анатомически размещается та или иная барьерная ткань:
TALT — носоглотка, евстахиева труба, ухо.
NALT — носовая полость, рот и ротоглотка, конъюнктива.
BALT — трахея, бронхи, легкие, грудные железы (у женщин).
GALT — 1) пищевод, желудок, тонкий кишечник;
2) толстый кишечник и проксимальные отделы урогенитального тракта; дистальные отделы урогенитального тракта.
SALT — кожа (дерма).
МАЛТ — это самая большая часть иммунной системы, где на общей площади 400 м 2 располагаются около 50% иммунокомпетентных клеток. Здесь представлены клетки как врожденного иммунитета, так и приобретенного. Кроме клеток в МАЛТ сконцентрированы и другие механизмы защиты [1].
В любой части МАЛТ механизмы защиты имеют сходную организацию (хотя есть и различия между этажа-
ми) [2–6]:
Верхний «инертный» барьер представляет собой слой слизи или, в случае кожи, «сухой» слой, состоящий из кератина. Основные защитные факторы, представленные на этом уровне, — это физический барьер, противомикробные пептиды, секреторный IgA, компоненты системы комплемента и микробиота. Очевидно, что инертность этой структуры весьма условна, т. к. здесь постоянно протекают активные реакции киллинга микроорганизмов и множество биохимических процессов метаболической направленности.
Эпителиальный пласт долгое время рассматривался только как физический барьер. Сегодня подобное представление существенно изменилось. Во-первых, было установлено, что эпителиальные клетки экспрессируют отвечающие за взаимодействие с микроорганизмами рецепторы, которые способны запускать активацию этих клеток с последующей продукцией противомикробных пептидов, а также каскадом регуляторных молекул (цитокинов) и экспрессией на эпителиоцитах корецепторов для клеток иммунной системы. Во-вторых, в составе «непроницаемого» эпителиального пласта были обнаружены дендритные клетки (преимущественно ротовая полость, дыхательная система, урогенитальный тракт, кожа) и multifold, или М-клетки (тонкий кишечник, миндалины, аденоиды), осуществляющие контролируемый перенос через барьер внутрь организма чужеродного материала. Этот контролируемый «трафик» необходим для поддержания в «тонусе» барьерного иммунитета и оповещения иммунной системы об изменяющемся окружении (например, о дисбалансе микробиоты или о попадании на слизистые и кожу патогенных микроорганизмов). Иначе говоря, иммунная система барьерных тканей находится все время в состоянии «тлеющей» активации, что позволяет ей быстро и эффективно реагировать на агрессию [7].
Подэпителиальная рыхлая соединительная ткань lamina propria (собственная пластинка), где диффузно, в высокой концентрации располагаются клетки врожденного иммунитета: несколько популяций дендритных клеток, макрофаги, естественные киллеры, гранулоциты, лимфоциты врожденного иммунитета и т. д. [8–10].
Под эпителием в lamina propria находятся так называемые «изолированные лимфоидные фолликулы», которые являются представительством адаптивного иммунитета в барьерных тканях. Эти фолликулы имеют четкую организацию с Т- и В-клеточными зонами и герминативным центром. Т-клеточные зоны содержат практически все субпопуляции αβTCR CD4+ T-хелперов (Th1, Th2 и Th17), продуцирующие ИЛ-10 Т-регуляторные клетки, CD8+ T-эффекторы. В составе В-клеточных зон преобладают В-лимфоциты, секретирующие IgA. Именно в эти фолликулы дендритные клетки и М-клетки доставляют антигенный материал, инициируя адаптивный иммунный ответ. Адаптивная иммунная система барьерных тканей тесно связана с регионарными лимфатическими образованиями: пейеровыми бляшками, аппендиксом, миндалинами и т. д., которые позволяют перевести иммунный ответ с местного уровня на системный [8].
Таким образом, МАЛТ обеспечивает многоуровневую защиту организма от проникновения патогенов и чужеродных веществ: от «пассивной» гуморальной, через активный антиген-неспецифический врожденный иммунитет, к высокоспецифическому адаптивному иммунитету, с возможностью перехода с местного уровня на системный.
Помимо единой структурной организации, описанной выше, существует еще одна особенность, делающая МАЛТ отдельной (и даже почти автономной в некотором смысле) подсистемой в рамках общего иммунитета. Это так называемый «закон хоминга МАЛТ». В соответствии с этим законом активация адаптивного иммунитета в какойлибо части МАЛТ приводит к формированию пула антиген-специфических клеток, часть которого остается в месте начала иммунного ответа, а другая выходит в системный кровоток и расселяется (хоминг) только в другие компартменты МАЛТ. Например, если проникновение патогена произошло в кишечнике (GALT), то через некоторое время секретирующие патоген-специфические IgA В-лимфоциты можно будет обнаружить в бронхолегочных лимфатических фолликулах lamina propria (BALT). За счет этого механизма формируется глобальная защита всех барьерных тканей.
Интерес к открытию и характеристике сигнальных рецепторов врожденного иммунитета (signal pattern-recognizing receptor — sPRR) обусловлен не только Нобелевской премией в области биологии и медицины 2011 г., но и важными прикладными аспектами: от понимания, как в организме осуществляются первые события противоинфекционной защиты, до создания новых лекарств для терапии хронических воспалительных, аутоиммунных и аутовоспалительных заболеваний.
sPRR являются основными рецепторами, осуществляющими связь между клетками врожденного иммунитета и другими клетками организма, включая нелимфоидные клетки и клетки адаптивного иммунитета. Они объединяют воедино все компоненты иммунной системы и координируют ее деятельность. С помощью этих рецепторов врожденный иммунитет распознает высококонсервативные структурные молекулы, имеющиеся у больших таксономических групп микроорганизмов (табл. 1). 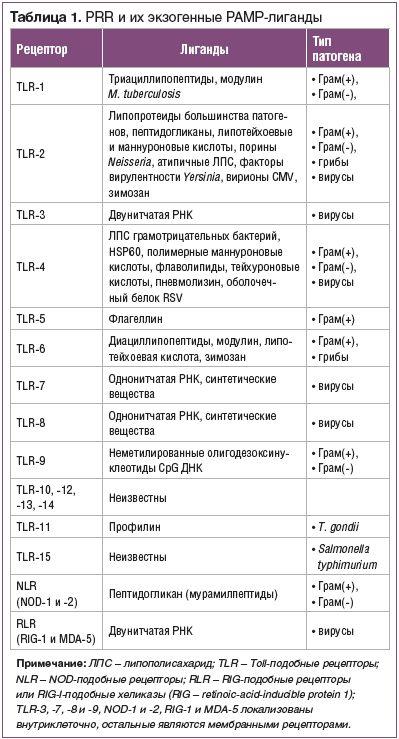
Эти молекулы получили название «патоген-ассоциированных молекулярных образов» (patogen-associated molecular patterns — PAMP). Наиболее известными PAMP являются бактериальный липополисахарид (ЛПС) (Грам(-) — грамотрицательные бактерии), липотейхоевые кислоты (Грам(+) — грамположительные бактерии), пептидогликан (ПГ) (грамотрицательные и грамположительные бактерии), маннаны, бактериальная ДНК, двуспиральная РНК вирусов, глюканы грибов и т. д. [11].
Рецепторы врожденного иммунитета, которые отвечают за распознавание РАМР, были названы «образ-распознающими» (pattern-recognition receptors — PRR) [11]. По функции их можно разделить на две группы: эндоцитозные и сигнальные. Эндоцитозные PRR (маннозные
рецепторы и рецепторы-мусорщики) в иммунологии известны достаточно давно — они обеспечивают процессы фагоцитоза с последующей доставкой патогена к лизосомам (начало адаптивного иммунного ответа).
Среди sPRR наибольшее значение имеют три семейства: Toll-подобные (TLR), NOD-подобные (NLR) и RIG-подобные рецепторы (RLR). Последние два семейства включают по 2 представителя PRR (NOD-1 и -2; RIG-1 и MDA-5), локализованных внутриклеточно и формирующих механизм «оповещения о несанкционированном прорыве» бактериального (NLR) или вирусного (RLR) патогена внутрь клетки или «побега» его из фаголизосомы [12, 13].
Наиболее изученными из sPRR являются Toll-подобные рецепторы (TLR). Данные рецепторы впервые были
описаны у дрозофил, у которых они, с одной стороны, отвечают за эмбриональное развитие, а с другой — обеспечивают антигрибковый иммунитет [14]. Сегодня у млекопитающих и человека охарактеризованы 15 TLR, которые расположены на мембране, в эндосомах или в цитоплазме клеток, осуществляющих первую линию защиты (нейтрофилы, макрофаги, дендритные, эндотелиальные и эпителиальные клетки кожных и слизистых покровов) [15–17].
В отличие от отвечающих за фагоцитоз эндоцитозных PRR, взаимодействие ТLR с соответствующим РАМР не сопровождается поглощением патогена, но приводит к изменению экспрессии большого количества генов и, в частности, генов провоспалительных цитокинов, которая опосредуется через последовательную активацию адапторных белков (например, MyD88), протеинкиназ (например, IRAK-4) и транскрипционных факторов (например, NF-κB) [18–20].
На уровне организма активация синтеза и секреции провоспалительных цитокинов (интерлейкины (ИЛ) -1, -2, -6, -8, -12, фактор некроза опухолей альфа (ФНО-α), интерферон-γ, гранулоцитарно-макрофагальный колониестимулирующий фактор) вызывает развитие воспалительной реакции с подключением всех имеющихся систем защиты от инфекционных агентов. На клеточном уровне эффект реализуется в трех направлениях. Во-первых, происходят активация самих клеток, несущих sPRR, и значительное усиление их защитного потенциала (продукция противомикробных пептидов и комплемента, фагоцитоз, переваривающая активность, продукция активных форм кислорода). Во-вторых, уже имеющиеся антиген-специфические клетки адаптивного иммунитета переходят в активированное состояние и усиливают свои эффекторные функции. В частности, зрелые В-лимфоциты увеличивают продукцию иммуноглобулинов (sIgA) и становятся более чувствительными к антигенной стимуляции, а Т-эффекторы наращивают киллерные функции. И, в‑третьих, происходят активация (прайминг) наивных лимфоцитов и подготовка их к началу адаптивного иммунного ответа [21, 22].
Именно через sPRR барьерный эпителий и мукозальные дендритные клетки распознают на ранних стадиях попытки инвазии микроорганизмов. Через эти же рецепторы клетки врожденного и адаптивного иммунитета подслизистого слоя или собственно дермы реагируют на уже проникшие через барьер патогены. Для реализации эффекта с sPRR не требуется пролиферации клеток и формирования антиген-специфического клона (необходимых при адаптивном иммунном ответе), и эффекторные реакции после распознавания данными рецепторами РАМР наступают немедленно. Этот факт объясняет высокую скорость врожденных иммунных механизмов элиминации патогена [23].
Иммунитет слизистых оболочек. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия Аббревиатура malt иммунология
В барьерных тканях (слизистые и кожа) расположена многоуровневая система защиты организма от чужеродных инфекционных и химических агентов, получившая название «мукозоассоциированная лимфоидная ткань» (МАЛТ). Она включает в себя гуморальные факторы и клетки врожденного и адаптивного иммунитета, а также неиммунные механизмы защиты. Одним из важных компонентов защиты барьерных тканей является микробиота, комменсалы которой, с одной стороны, осуществляют метаболическую функцию и прямую противопатогенную активность, а с другой — постоянно стимулируют МАЛТ на разных уровнях и, таким образом, поддерживают иммунитет барьерных тканей в состоянии «тлеющей» активации и готовности к быстрому ответу на вторжение чужеродных организмов или веществ. Антибиотики, являясь одними из наиболее часто назначаемых лекарственных препаратов, нарушают количество, состав и активность симбиотических микроорганизмов. Как следствие, происходит ослабление иммунитета барьерных тканей, что способствует заселению слизистых и кожи патогенными микроорганизмами и, в частности, их антибиотикорезистентными штаммами.
В барьерных тканях (слизистые и кожа) расположена многоуровневая система защиты организма от чужеродных инфекционных и химических агентов, получившая название «мукозоассоциированная лимфоидная ткань» (МАЛТ). Она включает в себя гуморальные факторы и клетки врожденного и адаптивного иммунитета, а также неиммунные механизмы защиты. Одним из важных компонентов защиты барьерных тканей является микробиота, комменсалы которой, с одной стороны, осуществляют метаболическую функцию и прямую противопатогенную активность, а с другой — постоянно стимулируют МАЛТ на разных уровнях и, таким образом, поддерживают иммунитет барьерных тканей в состоянии «тлеющей» активации и готовности к быстрому ответу на вторжение чужеродных организмов или веществ. Антибиотики, являясь одними из наиболее часто назначаемых лекарственных препаратов, нарушают количество, состав и активность симбиотических микроорганизмов. Как следствие, происходит ослабление иммунитета барьерных тканей, что способствует заселению слизистых и кожи патогенными микроорганизмами и, в частности, их антибиотикорезистентными штаммами. Осознание этого факта требует изменения тактики назначения антибиотиков и введения дополнительных лекарственных препаратов с целью поддержания активности МАЛТ. Препаратами — кандидатами на дополнение к этиотропной противоинфекционной терапии являются паттерны симбиотических микроорганизмов (microbial-associated molecular patterns (МАМР)) или, что более реально с точки зрения фармакологии, их минимальные биологически активные фрагменты (МБАФ).
Общая иммунная система слизистых оболочек (Mucosa-associated immune system-mais)
В настоящее время огромное внимание уделяется роли иммунной системы слизистых оболочек в резистентности организма прежде всего к различным инфекционным агентам. За последние 20 лет накоплены обширные знания о структуре и функции иммунной системы слизистых, ее взаимодействии с интегральной иммунной системой и физиологической микрофлорой, способности мукозальной иммунной системы вырабатывать толерантность на одни антигены и одновременно развивать иммунный ответ на другие.
В процессе формирования представлений об эндоэкологии человека пришло убеждение, что одним из важнейших условий сохранения здоровья является правильное развитие физиологической микрофлоры слизистых в раннем постнатальном периоде, ее последующее первостепенное значение в становлении мукозальной иммунной системы и их постоянное взаимодействие на протяжении всей жизни индивидуума.
Известно, что в пище, которую мы потребляем, в воде и в воздухе, содержится большое количество различного рода экзогенных бактерий, которые при попадании в организм могут вызвать его заболевание. Первым барьером, который принимает на себя основной удар при контакте с этими микроорганизмами, является поверхность слизистых оболочек нашего организма: полости носа, дыхательных путей, пищеварительного тракта, мочеполовых путей и др.
Существует большое количество неспецифических и специфических механизмов, которые берут участие в предотвращении заболевания. Неспецифические факторы защиты включают механизмы, которые влияют на рост микроорганизмов или их способность прикрепляться к поверхности эпителия и проникать через него в организм. Слюна, желудочный сок, желчь, слизь, перистальтика кишок – все это относится к неспецифическим факторам, которые помогают под¬держивать гомеостаз организма.
Иммунная система слизистых оболочек, так же как и интегральная иммунная система, делится на врожденный (неспецифический) иммунитет и приобретенный (специфический или адаптивный) иммунитет.
Гуморальное и клеточное звенья факторов врожденного (неспецифического) иммунитета представлены ниже.
Врожденный (неспецифический) иммунитет.
Барьерные белки (мукус)-муцины
- коллектины А и Д
- фиколины (L, M, H, P) Лизоцим Лактоферин Липокалины Ингибиторы протеаз
- α2-макроглобулин, серпин, цистатин С
- SLPI, SKALP/elafin
- Дендритные клетки
- Моноциты/макрофаги
- Интраэпителиальные Т-лимфоциты
- Нейтрофилы
- Тучные клетки
- Эозинофилы
- Естественные киллеры
Подсчитано, что в совокупности гуморальное звено сегодня насчитывает более 700 представителей, в целом имеющих огромный защитный потенциал.
Клеточное звено врожденного иммунитета слизистых представлено клетками, входящими в состав интегральной иммунной системы, за исключением интраэпителиальных Т-лимфоцитов, об особенностях которых будет сказано ниже.
В настоящем обзоре основное внимание будет уделено современным представлениям о струк¬туре и функции специфического (приобретенного) иммунитета слизистых кишечника.
Большинство антигенов поступают в организм через поверхность слизистых, и прежде всего, слизистой кишечника. Кишечник-ассоциированная лимфоидная ткань (GALT – gut-associated lymphoid tissue) содержит приблизительно 80% В-клеток всей иммунной системы (т.е. около 1010 клеток на 1 метр кишечника – Brandtzaeg et al., 1989). Количество IgА, которое продуцируется ежедневно и проходит через просвет кишечника у взрослых в виде секреторного IgА составляет 40мг/кг ( Conley a . Delacroix , 1987). Число Т-лимфоцитов и антигенпрезентирующих клеток в кишечнике вместе составляет около 60% общей популяции иммуноцитов (Ogra et al., 1999).
Несколько десятилетий тому назад было показано, что слизистые желудочно-кишечного, бронхиального и назо-фарингеального трактов содержат лимфоидные скопления, которые получили название мукоза-ассоциированная лимфоидная ткань (MALT – mucosa-associated lymphoid tissue). В последующем описали свойства, характерные для желудочно-кишечного и респираторного трактов более подробно, и разделили их, описав общие признаки и указав на существование признаков, которые их отличают. Таким образом, сегодня можно говорить, по крайней мере, о трех главных участках мукозальной лимфоидной ткани, которые получили соответствующие названия: лимфоидная ткань, ассоциированная с кишечником (GALT); лимфоидная ткань, ассоциированная с носоглоткой (NALT – nasal-associated lymphoid tissue); лимфоидная ткань, ассоциированная с бронхами (BALT – bronchus- associated lymphoid tissue) (Kiyono H. yet al., 2004; Kunisawa et al., 2005). Скопления лимфоидной ткани, расположенные в разных областях организма, имеют достаточно много общего в своей клеточной организации, например, наличие дискретных Т- и В-клеточных областей, однако, каждое из этих лимфоидных скоплений имеет и свои особенности. Следует упомянуть еще об одном определении. Необходимо отметить, что в рамках этих лимфоидных скоплений иммунный ответ реализуют представители иммунной системы: Т- и В-клетки, их популяции и субпопуляции, обеспечивая реализацию иммунного ответа на территории лимфоидной ткани слизистых оболочек; эти структуры получили название мукоза-ассоциированная иммунная система (MAIS – mucosa-associated immune sуstem).
Мукоза-ассоциированная иммунная система характеризуется следующими признаками:
- Специализированными эпителиальными клетками для специфического захвата антигена, т.н. М-клетки.
- Скоплением В-лимфоцитов, напоминающих по своей структуре фолликул.
- Наличием интрафолликулярных областей, где преимущественно расположены Т-лимфоциты вокруг высокоэндотелиальных венул (high endothelial venule)..
- Наличием В-лимфоцитов – предшественников IgA-секретирующих плазматических клеток, которые примируются на территории фолликулов.
- Способностью предшественников IgA-продуцирующих клеток мигрировать через лимфу в региональные лимфатические узлы и далее распространяться по lamina propria всех ор-ганов, имеющих слизистую оболочку.
Слизистые оболочки имеют общую поверхность более 400 м2 (тогда как кожа -1,8 м2), а их иммунная система разделена на две зоны: индуктивную и эффекторную. В индуктивной зоне происходят процессы иммунологического распознавания, презентации антигена и формируется популяция антигенспецифических лимфоидных клеток.
В эффекторной зоне продуцируется секреторный IgA (sIgA) и накапливаются эффекторные Т-лимфоциты, обеспечивающие клеточно-опосредованные формы защиты поверхности слизи-стых оболочек.
В зависимости от места проникновения в организм, антиген распознается в индуктивной зоне соответствующего участка иммунной системы слизистой (GАLТ, NALT или BALT). Примированные Т- и В-лимфоциты мигрируют в регионарный лимфатический узел, затем через грудной лимфатический проток и циркулирующую кровь расселяются в эффекторных зонах всех представителей общей мукозальной иммунной системы, где и реализуют свои защитные функции.
Большинство антигенов попадают в организм ингаляционным путем и через пищеварительный канал, где и происходит их первичный контакт с лимфоретикулярной тканью этих органов. Лимфоретикулярная ткань бронхов и кишок составляет значительную часть всей иммунной системы слизистых оболочек. Антигенная стимуляция, независимо от того, где она произошла, в кишках или в бронхах, ведет к последующей диссеминации антигенспецифиче-ских В- и Т-лимфоцитов во все эффекторные участки слизистых оболочек, включая желудок, кишечник, дыхательные и мочеполовые пути, а также различные секреторные железы.



